Thermoplaste: Unterschied zwischen den Versionen
(→Radikalketten-Mechanismus) |
(→Recycling-Code) |
||
| (133 dazwischenliegende Versionen von 6 Benutzern werden nicht angezeigt) | |||
| Zeile 2: | Zeile 2: | ||
''Gruppe von Lena, Paulina, Daniel, Alexander, Laura und Lea!'' | ''Gruppe von Lena, Paulina, Daniel, Alexander, Laura und Lea!'' | ||
| − | Kaum ein Tag vergeht an dem wir nicht mit Kunststoffen in Kontakt treten. In unserer modernen Welt sind sie ein beliebter Werkstoff welcher vielfältig eingesetzt wird, zum Beispiel in der Fahrzeug- oder der Textilindustrie. Doch Kunststoff ist nicht gleich Kunststoff. | + | Kaum ein Tag vergeht an dem wir nicht mit Kunststoffen in Kontakt treten. In unserer modernen Welt sind sie ein beliebter Werkstoff, welcher vielfältig eingesetzt wird, zum Beispiel in der Fahrzeug- oder der Textilindustrie. Doch Kunststoff ist nicht gleich Kunststoff. Verschiedene Bedürfnisse benötigen verschiedene Eigenschaften. |
Für den Einsatzbereich entscheidend sind Eigenschaften wie ''Temperaturbeständigkeit, Verformbarkeit und Elastizität''. Es ergeben sich die drei Gruppen: [[#Thermoplast|'''Thermoplaste''']], [[#Duroplast|'''Duroplaste''']] und [[#Elastomer|'''Elastomere''']]. | Für den Einsatzbereich entscheidend sind Eigenschaften wie ''Temperaturbeständigkeit, Verformbarkeit und Elastizität''. Es ergeben sich die drei Gruppen: [[#Thermoplast|'''Thermoplaste''']], [[#Duroplast|'''Duroplaste''']] und [[#Elastomer|'''Elastomere''']]. | ||
= {{Anker|Makromolekül}} Makromoleküle= | = {{Anker|Makromolekül}} Makromoleküle= | ||
Makromoleküle sind meistens [[Polymer|Polymere]] und werden umgangssprachlich auch als „Riesenmolekül“ bezeichnet, da es sich um sehr große Moleküle handelt. | Makromoleküle sind meistens [[Polymer|Polymere]] und werden umgangssprachlich auch als „Riesenmolekül“ bezeichnet, da es sich um sehr große Moleküle handelt. | ||
| − | Sie bestehen aus sich wiederholenden, gleichen oder unterschiedlichen Atomen oder Atomgruppen, die aus [[ | + | Sie bestehen aus sich wiederholenden, gleichen oder unterschiedlichen Atomen oder Atomgruppen, die aus [[#Monomer|Monomere]] gebildet werden. Durch ihre Größe hat eine Wegnahme oder Aufnahme von Atomen keinen Einfluss auf die Eigenschaften. |
| − | Ein Beispiel für | + | Ein Beispiel für synthetische Makromoleküle sind zum Beispiel Kunststoffe. |
= {{Anker|Monomer}} Monomere= | = {{Anker|Monomer}} Monomere= | ||
| − | Moleküle aus denen Makromoleküle gebildet werden nennt man Monomere. "Monomeres" ist griechisch für einfach und einteilig, was gut die Funktion des Monomers beschreibt, denn es ist die kleinste Einheit welche immer | + | Moleküle aus denen [[#Makromolekül|Makromoleküle]] gebildet werden nennt man Monomere. "Monomeres" ist griechisch für einfach und einteilig, was gut die Funktion des Monomers beschreibt, denn es ist die kleinste Einheit, welche immer wiederkehrt. Durch [[#Polymerisation|Polymerisation]], [[Polykondensation|Polykondensation]] oder Polyaddition reagieren sie zu [[Polymer|Polymeren]] (Makromolekülen). |
| − | Man unterscheidet zwischen Homo[[Polymer|polymer]]en und Co[[Polymer|polymeren]], letztere sind [[Polymer]] | + | Man unterscheidet zwischen Homo[[Polymer|polymer]]en und Co[[Polymer|polymeren]], letztere sind [[Polymer]]e aus unterschiedlichen Monomeren. |
| − | Bei Homo[[Polymer|polymer]]en wird ausschließlich eine Monomer-Art benutzt. | + | Bei Homo[[Polymer|polymer]]en wird ausschließlich eine Monomer-Art benutzt. |
| − | + | ||
Aufgebaut sind Monomere meist durch eine C=C Doppelbindung, allerdings sind auch weitere Moleküle denkbar - wichtig sind mindestens zwei funktionelle Gruppen pro Molekül. | Aufgebaut sind Monomere meist durch eine C=C Doppelbindung, allerdings sind auch weitere Moleküle denkbar - wichtig sind mindestens zwei funktionelle Gruppen pro Molekül. | ||
Ein bekanntes Beispiel ist das [[Ethen]] (Ethylen), es wird für Tragetaschen, Eimer und Mülltonnen benutzt. | Ein bekanntes Beispiel ist das [[Ethen]] (Ethylen), es wird für Tragetaschen, Eimer und Mülltonnen benutzt. | ||
| − | |||
| − | |||
= {{Anker|Thermoplast}} Thermoplast= | = {{Anker|Thermoplast}} Thermoplast= | ||
| Zeile 24: | Zeile 21: | ||
Thermoplaste sind Kunststoffe, die bei einer bestimmten Temperatur verformbar sind. Das Wort Thermoplaste lässt sich in zwei Teile aufteilen: "Thermo" steht für Wärme und "Plasten" bedeutet formen. | Thermoplaste sind Kunststoffe, die bei einer bestimmten Temperatur verformbar sind. Das Wort Thermoplaste lässt sich in zwei Teile aufteilen: "Thermo" steht für Wärme und "Plasten" bedeutet formen. | ||
Bei niedrigen Temperaturen sind die Kunststoffe fest. Erwärmt man den Stoff gelangt er zunächst in den thermoelastischen Bereich, indem der Stoff verformbar ist, aber anschließend wieder seine ursprüngliche Form annimmt (bspw. ein Schwamm bei Raumtemperatur) . Wenn man den Kunststoff noch weiter erhitzt, gelangt man in den thermoplastischen Bereich, wo der Stoff ebenfalls verformbar ist, aber im Gegensatz zum anderen Bereich, nicht mehr in seine Ursprungsform zurückgeht. Zuletzt kann man die Kunststoffe so weit erhitzen, bis sie flüssig werden und sich schlussendlich zersetzen. | Bei niedrigen Temperaturen sind die Kunststoffe fest. Erwärmt man den Stoff gelangt er zunächst in den thermoelastischen Bereich, indem der Stoff verformbar ist, aber anschließend wieder seine ursprüngliche Form annimmt (bspw. ein Schwamm bei Raumtemperatur) . Wenn man den Kunststoff noch weiter erhitzt, gelangt man in den thermoplastischen Bereich, wo der Stoff ebenfalls verformbar ist, aber im Gegensatz zum anderen Bereich, nicht mehr in seine Ursprungsform zurückgeht. Zuletzt kann man die Kunststoffe so weit erhitzen, bis sie flüssig werden und sich schlussendlich zersetzen. | ||
| − | Die Grundstruktur eines Thermoplasts besteht aus mehreren nebeneinander verlaufenden Ketten ([[Polymer|Polymer]]en), welche untereinander nicht vernetzt sind. Diese sind für die thermoplastische Eigenschaft verantwortlich. Somit gilt: Je höher die Temperatur ist, desto besser können die einzeln vorliegenden [[Polymer|Polymer]]en (lineare/strauchähnlich verzweigte [[#Makromolekül|Makromoleküle]]) gegeneinander verschoben werden. Die Verschiebung wiederum ist für die Elastizität notwendig. Man unterscheidet hier zwischen zwei Bereichen. In dem kristallinen Bereich liegen die Ketten geordnet nebeneinander vor und im | + | Die Grundstruktur eines Thermoplasts besteht aus mehreren nebeneinander verlaufenden Ketten ([[Polymer|Polymer]]en), welche untereinander nicht vernetzt sind. Diese sind für die thermoplastische Eigenschaft verantwortlich. Somit gilt: Je höher die Temperatur ist, desto besser können die einzeln vorliegenden [[Polymer|Polymer]]en (lineare/strauchähnlich verzweigte [[#Makromolekül|Makromoleküle]]) gegeneinander verschoben werden. Die Verschiebung wiederum ist für die Elastizität notwendig. Man unterscheidet hier zwischen zwei Bereichen. In dem kristallinen Bereich (1. Abb.) liegen die Ketten geordnet nebeneinander vor und im amorphen Bereich (2. Abb.) liegen die einzelnen Ketten ungeordnet und verknäult vor. Je mehr kristalline Bereiche es gibt, desto härter und spröder ist ein Thermoplast. |
[https://www.youtube.com/watch?v=Il6hPdAkdfA Zur Veranschaulichung der verschiedenen Bereiche dient dieses Video] | [https://www.youtube.com/watch?v=Il6hPdAkdfA Zur Veranschaulichung der verschiedenen Bereiche dient dieses Video] | ||
| − | [[Datei:Beispiel-kristallin.jpg|150px|kristalline Bereiche]] | + | [[Datei:Beispiel-kristallin.jpg|150px|kristalline Bereiche|150px|kristalline Bereiche]] |
| − | [[Datei:Beispiel-amorph.jpg|150px|amorphe Bereiche]] | + | [[Datei:Beispiel-amorph.jpg|150px|amorphe Bereiche|150px|amorphe Bereiche]] |
= {{Anker|Duroplast}} Duroplast= | = {{Anker|Duroplast}} Duroplast= | ||
| − | Als [http://chemie-digital.zum.de/wiki/Benutzer:Cloehner/Kunststoffe/Duroplaste | + | Als [http://chemie-digital.zum.de/wiki/Benutzer:Cloehner/Kunststoffe/Duroplaste Duroplasten] bezeichnet man einen sehr harten, stabilen Kunststoff. Er wird aus [[#Monomer|Monomeren]] durch [[Polykondensation|Polykondensation]] künstlich zusammengesetzt. Durch Atombindungen sind Molekülketten engmaschig 3D verknüpft und daher nur wenig beweglich (Abbildung). Es bestehen mindestens 2-3 Bindungen und somit werden auch mehr als 2 funktionelle Gruppen benötigt. |
| − | Anders als [[#Thermoplast|Thermoplaste]] sind | + | Anders als [[#Thermoplast|Thermoplaste]] sind Duroplaste nicht schmelzbar und nicht durch Lösemittel auflösbar. Bei Hitze zersetzten sie sich lediglich, denn ihre Atombindungen werden gespalten. |
| − | Allerdings sind Duroplasten, im Gegensatz zu | + | Allerdings sind Duroplasten, im Gegensatz zu [[#Elastomer|Elastomere]], hart, spröde und können zerbrechen. |
Aufgrund ihrer Eigenschaften werden sie oft in Computern oder auch Autos verbaut, denn sie sind hitzebeständig, sehr stabil und nicht verformbar. | Aufgrund ihrer Eigenschaften werden sie oft in Computern oder auch Autos verbaut, denn sie sind hitzebeständig, sehr stabil und nicht verformbar. | ||
= {{Anker|Elastomer}} Elastomer= | = {{Anker|Elastomer}} Elastomer= | ||
| − | Die [http://chemie-digital.zum.de/wiki/Benutzer:Cloehner/Kunststoffe/Elastomere Elastomere] gehören zu den Kunststoffen. Sie unterscheiden sich jedoch von den anderen Kunststoffen, wie den [[#Thermoplast|Thermoplasten]] und den Duroplasten besonders durch ihre hohe Elastizität. Daher werden diese | + | Die [http://chemie-digital.zum.de/wiki/Benutzer:Cloehner/Kunststoffe/Elastomere Elastomere] gehören zu den Kunststoffen. Sie unterscheiden sich jedoch von den anderen Kunststoffen, wie den [[#Thermoplast|Thermoplasten]] und den [[#Duroplast|Duroplasten]], besonders durch ihre hohe Elastizität. Daher werden diese Kunststoffe umgangssprachlich auch als „Gummi“ bezeichnet. Ein Beispiel für ein Elastomer wäre somit ein Schwamm oder auch ein Autoreifen. Die Elastomere bestehen aus kleinen organischen Einheiten, diese werden auch als [[#Monomer|Monomer]] bezeichnet. Durch Vorgänge wie die [[#Polymerisation|Polymerisation]], Polyaddition und Polykondensation werden sie künstlich zusammengeknüpft und liegen anschießend „verknäult“ vor.Eine Besonderheit bei den |
Elastomeren ist, dass sie durch Kälte spröde werden. | Elastomeren ist, dass sie durch Kälte spröde werden. | ||
| − | Zu einer Zersetzung kommt es jedoch erst ab ca. 300 Grad Celcius. Außerdem | + | Zu einer Zersetzung kommt es jedoch erst ab ca. 300 Grad Celcius. Außerdem lassen sich Elastomere durch Druck bzw. Zug verformen, gehen anschließend aber wieder ihre Ausgangsform zurück. Dabei speichern sie zudem keine Energie. |
| − | Ein weiteres Merkmal ist die schlechte Löslichkeit der Elastomere, da sie nicht schmelzbar sind und sich auch nicht in Lösungsmittel auflösen. Dies lässt sich auf die | + | Ein weiteres Merkmal ist die schlechte Löslichkeit der Elastomere, da sie nicht schmelzbar sind und sich auch nicht in Lösungsmittel auflösen. Dies lässt sich auf die weitmaschige 2D Verknüpfung der [[#Monomer|Monomere]] zurückführen. |
<popup name="Aufgabe zu den 3 Hauptgruppen"> | <popup name="Aufgabe zu den 3 Hauptgruppen"> | ||
| − | <iframe src="https://learningapps.org/watch?v=pi6vycg6218" style="border:100px;width:100%;height: | + | <iframe src="https://learningapps.org/watch?v=pi6vycg6218" style="border:100px;width:100%;height:750px" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> |
[https://learningapps.org/watch?v=pi6vycg6218 Aufgabe zu den drei Haupttypen ] | [https://learningapps.org/watch?v=pi6vycg6218 Aufgabe zu den drei Haupttypen ] | ||
</popup> | </popup> | ||
| − | |||
| − | |||
| − | |||
| − | |||
= {{Anker|Polymerisation}} Polymerisation= | = {{Anker|Polymerisation}} Polymerisation= | ||
| − | Es gibt verschiedene Möglichkeiten Kunststoffe herzustellen. Man unterscheidet bei den Reaktionsarten zwischen der [[ | + | Es gibt verschiedene Möglichkeiten Kunststoffe herzustellen. Man unterscheidet bei den Reaktionsarten zwischen der [[Polykondensation|Polykondensation]], der Polyaddition und der Polymerisation. Das verwendete [[#Monomer|Monomer]] bestimmt hierbei die Reaktionsart. |
| − | Die | + | Die Polymerisation läuft ab wenn mindestens eine C=C Doppelbindung vorliegt. |
Dies ist entscheidend für den weiteren Verlauf der Reaktion, denn bei dieser brechen Doppelbindungen auf und die verschiedenen [[#Monomer|Monomer]]moleküle verbinden sich unter Ausbildung von C-C Einfachbindungen. Liegt nur eine Doppelbindung vor entstehen lange, unverzweigte Ketten. Dieses Verfahren stellt [[#Thermoplast|Thermoplasten]] her. | Dies ist entscheidend für den weiteren Verlauf der Reaktion, denn bei dieser brechen Doppelbindungen auf und die verschiedenen [[#Monomer|Monomer]]moleküle verbinden sich unter Ausbildung von C-C Einfachbindungen. Liegt nur eine Doppelbindung vor entstehen lange, unverzweigte Ketten. Dieses Verfahren stellt [[#Thermoplast|Thermoplasten]] her. | ||
| − | + | = {{Anker|Radikale}} Radikale= | |
| − | = {{Anker| | + | |
| − | + | ||
| − | + | ||
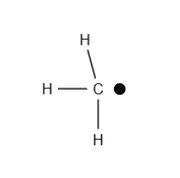
Radikale sind Atome oder Moleküle, die mindestens ein ungepaartes Valenzelektron besitzen. Valenzelektronen bestimmen die Wertigkeit eines Moleküls und sind für die chemische Bindung verantwortlich. Wegen des ungepaarten Elektrons handelt es sich hierbei um hochreaktive und wenig stabile Moleküle. Deswegen existieren Radikale meist nur sehr kurze Zeit (< 1 Sekunde); eine Ausnahme dabei stellen stabilisierte Radikale dar. Radikale werden mit einem Punkt dargestellt. Ein typisches Merkmal für Radikale ist es, dass sie häufig in Form einer Kettenreaktion reagieren. | Radikale sind Atome oder Moleküle, die mindestens ein ungepaartes Valenzelektron besitzen. Valenzelektronen bestimmen die Wertigkeit eines Moleküls und sind für die chemische Bindung verantwortlich. Wegen des ungepaarten Elektrons handelt es sich hierbei um hochreaktive und wenig stabile Moleküle. Deswegen existieren Radikale meist nur sehr kurze Zeit (< 1 Sekunde); eine Ausnahme dabei stellen stabilisierte Radikale dar. Radikale werden mit einem Punkt dargestellt. Ein typisches Merkmal für Radikale ist es, dass sie häufig in Form einer Kettenreaktion reagieren. | ||
| + | [[Datei:Radikalschreibweise.jpg|thumb|Der Punkt steht für das ungepaarte Valenzelektron]] | ||
=Radikalketten-Mechanismus= | =Radikalketten-Mechanismus= | ||
| + | Das Grundprinzip aller Herstellungsverfahren künstlicher [[Polymer]]e ist die Herstellung eines [[#Makromolekül|Makromoleküls]] aus den [[#Monomer|Monomeren]]. | ||
| + | Die einfachste Form, um ein [[#Makromolekül|Makromolekül]] herzustellen, ist die sogenannte Ketten[[#Polymerisation|polymerisation]]. Diese umfasst alle chemischen Reaktionen, bei denen sich fortlaufend gleiche oder unterschiedliche [[#Monomer|Monomere]] an ein wachsendes [[Polymer]] zusammensetzen. Bei der [[#Polykondensation|Polykondensation]] spalten sich kleine Moleküle ab und bei der [[Polymer|Poly]]addition gruppieren sich diese um, sodass man diese Verfahren nicht zu der [[#Polymerisation|Polymerisation]] dazuzählen darf. Die [[#Radikale|radikal]]ische [[#Polymerisation|Polymerisation]] ist unempfindlich, leicht von außen durch Zusatzstoffe zu steuern und zu kontrollieren und sie liefert schon bei recht kleinen Umsätzen hohe [[#Polymerisation|Polymerisation]]sgrade. Der [[#Polymerisation|Polymerisation]]sgrad beschreibt die Zahl der [[#Monomer|Monomere]], aus denen das [[Polymer]] letztendlich besteht. Der Mechanismus wird hauptsächlich für billigere Kunststoffe wie [[#PVC|PVC]], PS oder PE eingesetzt. Ein Reaktionsmechanismus beschreibt im Allgemeinen einen Prozess, der von Edukten bis Produkten ähnlich verläuft und von Elektronenbewegungen geprägt ist. | ||
| + | Bei der [[#Radikale|radikal]]ischen [[#Polymerisation|Polymerisation]] werden bestimmte Zwischenstufen immer wieder durchlaufen und die Edukte werden in einem kontinuierlichen Kreisprozess in Produkte umgewandelt. Die [[#Radikale|radikal]]ische [[#Polymerisation|Polymerisation]] beruht im Wesentlichen auf drei Teilschritten: | ||
| + | ===1.Startreaktion=== | ||
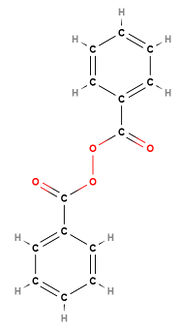
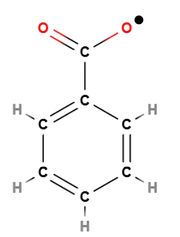
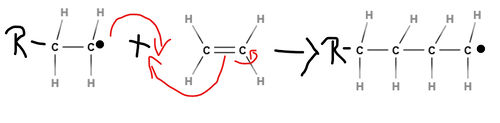
| + | Eine [[#Polymerisation|Polymerisation]]sreaktion muss durch Startmoleküle (Initiatoren) in Gang gesetzt werden, das heißt zu Beginn müssen [[#Radikale|Startradikale]] erzeugt werden. Diese werden meist aus organischen Peroxiden hergestellt, da diese instabile Moleküle darstellen und deswegen leicht irreversibel zerfallen. Das entstehende [[#Radikale|Startradikal]] spaltet die Doppelbindung eines Monomermoleküls auf und eine Umlagerung von Elektronen findet statt. Dadurch entsteht ein "verlängertes" [[#Radikale|Radikal]]. | ||
| + | <popup name=Initiator>[[Datei:Dibenzoylperoxidmolekül- Strukturformel.jpg|thumb|Strukturformel eines Dibenzoylperoxidmoleküls]] [[Datei:Dibenzoylperoxidmolekül zerfallen in ein Radikal.jpg|thumb|Strukturformel eines Dibenzoylperoxidmoleküls, welches in ein Radikal zerfallen ist (Beispiel für ein Initiator)]]</popup> | ||
| + | <popup name= Startreaktion>[[Datei:Startreaktion.jpg|500px|Erzeugung von [[#Monomer|Monomer]]-[[#Radikale|Radikal]]en]]</popup> | ||
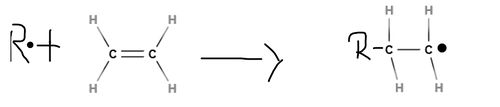
| − | === | + | ===2. Wachstumsreaktion === |
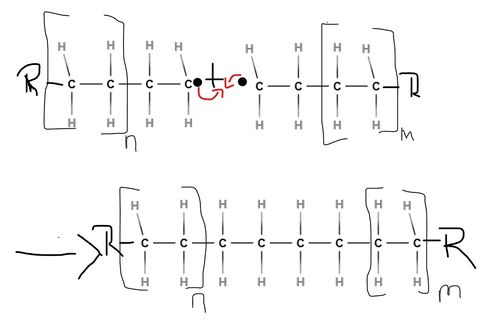
| + | Das in der Startreaktion entstandene [[#Radikale|Radikal]] reagiert mit einem weiteren Monomermolekül unter Kettenverlängerung. Es lagern sich nun also wiederholend neue [[#Monomer|Monomere]] an, ohne dass dabei eine weitere Zufuhr von Aktivierungsenergie nötig ist, da diese Reaktion stark exotherm ist. Durch die freiwerdende [[#Polymerisation|Polymerisation]]swärme werden weitere [[#Radikale|Radikal]]e erzeugt, sodass die Reaktion sich selbst beschleunigen kann, was im Extremfall zu einer Überlastung des Reaktionsmaterials und somit zu einer thermischen Explosion führen kann. Diese in Form von Wärme auftretende Energie muss also abgeführt werden, um die Zersetzung des [[#Makromolekül|Makromoleküls]] zu vermeiden. Die Wachstumsreaktion verläuft genauso wie die Startreaktion nur deutlich öfter. | ||
| + | <popup name=Wachstumsreaktion>[[Datei:Wachstumsreaktion.jpg|500px|Verlängerung der "Radikalkette"]]</popup> | ||
| − | === | + | ===3. Abbruchreaktion=== |
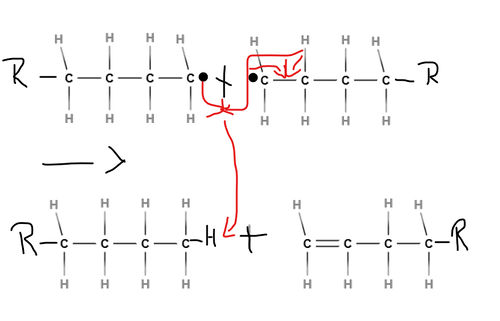
| + | Die Wachstumsreaktion setzt sich so lange fort, bis zwei [[#Radikale|Radikal]]e miteinander reagieren und somit einen Kettenabbruch bewirken, denn beide Moleküle bilden dann eine Elektronenpaarbindung zueinander aus. | ||
| + | <popup name= Abbruchsreaktion>[[Datei:Abbruchsreaktion.jpg|500px|"Vernichtung von [[#Radikale|Radikal]]en"]]</popup> | ||
| − | =Abbruchreaktion | + | Es gibt hierbei eine 2. Möglichkeit, dass die [[#Radikale|radikal]]ische [[#Polymerisation|Polymerisation]] abbricht: Innerhalb eines [[#Radikale|Radikal]]s kann sich ebenfalls eine Doppelbindung ausbreiten, sodass ein Wasserstoff-[[#Radikale|Radikal]] entsteht. Dieses bindet sich an ein anderes [[#Radikale|Radikal]]. |
| + | <popup name= Andere-Abbruchreaktion>[[Datei:2.Möglichkeit der Abbruchreaktion.jpg|500px|Ausbildung einer Doppelbindung innerhalb des [[#Radikale|Radikal]]s]]</popup> | ||
| + | <popup name= Aufgabe-zum-Radikalketten-Mechanismus> <iframe src="https://learningapps.org/watch?v=py8cnp4nk18" style="border:0px;width:100%;height:500px" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> </popup> | ||
| − | = | + | =Peptid-Gruppen= |
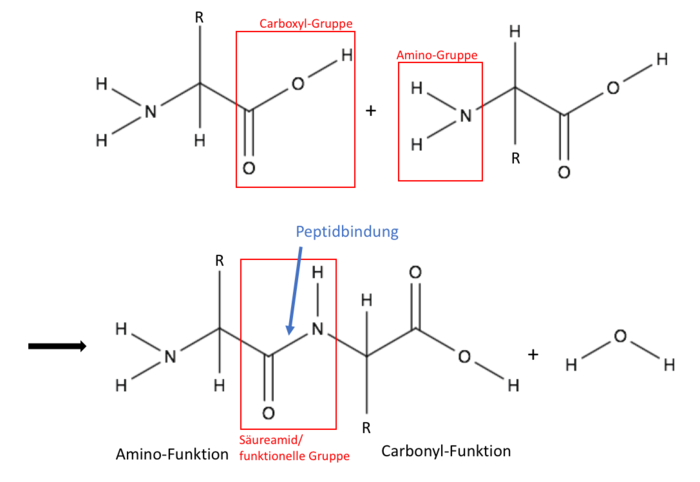
| − | + | Die Peptid-Gruppe ist eine (C=O)-(NH)-Gruppe, welche zwei Aminosäuren miteinander verbindet. Dies ist die Bindung zwischen der Carboxylgruppe einer Aminosäure und der Aminogruppe einer zweiten Aminosäure. | |
| − | + | ||
| − | + | ||
| − | = | + | <popup name=Peptidbindungreaktion>{| class="wikitable" width="100%" |
| + | |- | ||
| + | ! Peptidreaktion !! Beschreibung der Peptidreaktion | ||
| + | |- | ||
| + | | width="66%" | | ||
| + | [[Datei:Peptid-Reaktion.png|thumb|700px|Peptidreaktion]] | ||
| + | | width="66%" | | ||
| + | Die Peptid-Bindung ist eine kovalente chemische Bindung, die zwischen zwei Aminosäure unter Wasserabspaltung ausgebildet wird. Genauer gesagt zwischen dem Carbonyl-Kohlenstoffatom der Carboxyl-Gruppe und dem Stickstoffatom der Aminogruppe. Die entstandene funktionelle Gruppe ist ein Säureamid und ein charakteristisches Merkmal der Stoffgruppe der Peptide. Das Dipeptid besitzt eine weitere Amino-Funktion und eine Carbonyl-Funktion, die weitere Peptidbindungen zu anderen Aminosäuren ausbilden. Somit können beliebig lange Ketten aneinander gereihter Aminosäuren gebildet werden. | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |}</popup> | ||
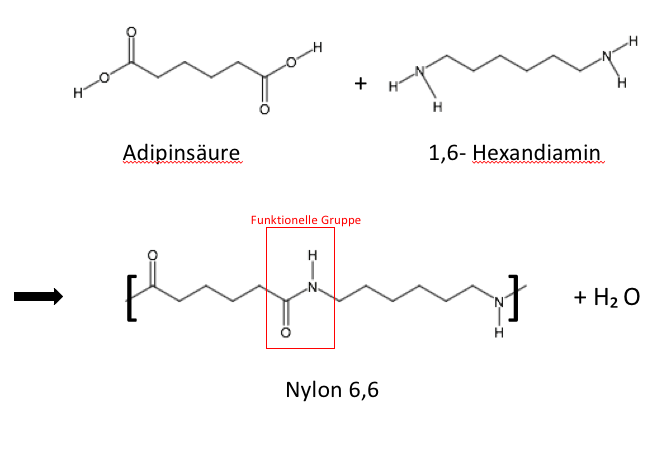
=Polyamid= | =Polyamid= | ||
| Zeile 95: | Zeile 144: | ||
[[Datei:Beispiel-Nylon.png|700px|Nylon]] | [[Datei:Beispiel-Nylon.png|700px|Nylon]] | ||
| width="66%" | | | width="66%" | | ||
| − | + | Nylon lässt sich durch die Polykondensation einer aliphantischen Dicarbonsäure mit Diarien herstellen. Erhitzt man eine Mischung der Feststoffe Adipinsäure und Hexandiamin erhält man eine Schmelze. Daraus lassen sich Nylonfäden ziehen. | |
| − | + | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| Zeile 139: | Zeile 177: | ||
| + | |}</popup> | ||
| + | = {{Anker|PET}} PET= | ||
| + | ===Herstellung=== | ||
| + | Polyethylenterephthalat (PET) ist ein durch [[Polykondensation|Polykondensation]] hergestellter [[#Thermoplast|thermoplastischer]] Kunststoff aus der Familie der [[Polyester|Polyester]]. PET wird aus [[#Monomer|Monomere]]n hergestellt, diese sind Terephtalsäure und Ethylenglykol. In neueren Verfahren wird Ethandiol mit Terephthalsäure direkt verestert. | ||
| + | ===Eigenschaften=== | ||
| + | {| class="wikitable" | ||
| + | ! PET !! Summenformel !! Dichte !! Schmelzpunkt!! Löslichkeit | ||
| + | |- | ||
| + | | PET | ||
| + | |C10H8O4 | ||
| + | |style="text-align:right"| 1,3 | ||
| + | |style="text-align:right"| >250°C | ||
| + | |praktisch unlöslich in Wasser | ||
| + | |} | ||
| + | ===Anwendung=== | ||
| + | Ein sehr großes Anwendungsgebiet für PET sind die [[Polyester|Polyester]]folien, die heute in Dicken von 1 bis 500 Mikrometern hergestellt werden. Ihre Anwendung geht über Dünnstfolien für Wickelkondensatoren, Schreibmaschinenbänder, Prägefolien, Verpackungsfolien für aromadichte Verpackungen, Möbelfolien, eingefärbte Lichtschutzfolien, Fotofilm, Röntgenfilm, Elektroisolierfolie, Ankernutisolierfolie bis zur Folie für Teststreifen in der pharmazeutischen Industrie. Ein großes Anwendungsgebiet waren auch Trägerfolien für Audio- und Videobänder. | ||
| + | Eines der bekanntesten Anwendungsgebiete für PET ist die Herstellung von PET-Flaschen aller Art und die Verarbeitung zu Textilfasern. Auch zur Herstellung alter Filmrollen wurde PET verwendet. | ||
| + | Zum [[#Recycling|Recycling]] des PET wurde ein Verfahren entwickelt, welches 2010 für den Deutschen Zukunftspreis nominiert wurde, bei der das PET der Flaschen sorgfältig in ihre Einzelteile zerlegt wird. | ||
| + | Im Jahr 2009 wurden europaweit 48,4% aller PET-Flaschen für das Recycling gesammelt und der Rest wurde verarbeitet. | ||
| + | = {{Anker|PVC}} PVC= | ||
| − | + | ===Herstellung=== | |
| − | + | Polyvinylchlorid (PVC) wird durch eine [[#Radikale|radikal]]ische oder ionische Ketten[[#Polymerisation|polimerisation]] aus dem [[#Monomer|Monomer]] Vinylchlorid (CH² = CHCl) erzeugt. | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | Polyvinylchlorid (PVC) wird durch eine | + | |
Um es herzustellen, kann man zum einen Ethin und zum anderen [[Ethen]] verwenden. Bei der ersten Möglichkeit findet die Reaktion zwischen Chlorwasserstoff(HCl) mit Ethin statt. | Um es herzustellen, kann man zum einen Ethin und zum anderen [[Ethen]] verwenden. Bei der ersten Möglichkeit findet die Reaktion zwischen Chlorwasserstoff(HCl) mit Ethin statt. | ||
| − | + | ||
Wenn eine Temperatur von 200°C gegeben ist und es unter Druck steht wird Chlorwasserstoff and die Dreifachbindung des Ethins addiert und bildet somit Vinylchlorid. Außerdem muss Quecksilber(II)chlorid als Katalysator vorhanden sein. | Wenn eine Temperatur von 200°C gegeben ist und es unter Druck steht wird Chlorwasserstoff and die Dreifachbindung des Ethins addiert und bildet somit Vinylchlorid. Außerdem muss Quecksilber(II)chlorid als Katalysator vorhanden sein. | ||
Diese Reaktion ist in dem vorliegenden Bild: Herstellung eines Vinylchlorids dargestellt: | Diese Reaktion ist in dem vorliegenden Bild: Herstellung eines Vinylchlorids dargestellt: | ||
| − | <br />[[Datei:MolView (structural formula)(2).png|Herstellung eines Vinylchlorids]] | + | <br /> |
| − | + | ||
| + | {| class="wikitable" width="100%" | ||
| + | |- | ||
| + | ! Vinylchloridreaktion !! Beschreibung der Reaktion | ||
| + | |- | ||
| + | | width="20%" | | ||
| + | [[Datei:MolView (structural formula)(2).png|Herstellung eines Vinylchlorids]] | ||
| + | | width="66%" | | ||
| + | Am Anfang der Reaktion sind Ethin (H-C=C-H) und Chlorwasserstoff (HCl) vorhanden. Diese werden durch Addition zu Chlorethen (Vinylchlorid). Allerdings ist dieses Verfahren veraltet und heutzutage wird Chlor und [[Ethen]] addiert, wodurch Dichlorethan entsteht, welches mithilfe eines Aluminiumoxid-Katalysators unter Abspaltung von Chlorwasserstoff(HCl) zu Vinylchlorid umgewandelt wird. | ||
| + | Nachdem das giftige Vinylchlorid hergestellt wurde wird es durch Zugabe der [[#Peroxide|Peroxide]] in der Ketten-[[#Polymerisation|Polymerisation]] zu festem Polyvinylchlorid. Somit erhält man Polyvinylchlorid, wenn man mindestens 2 [[#Monomer|Monomere]] Vinylchlorid miteinander polymerisiert. | ||
| + | |} | ||
| + | <br /> Den Verlauf der [[#Polymerisation|Polymerisation]] nochmals allgemeiner erläutert bedeutet, dass es durch eine [[#Radikal|radikal]]e [[#Polymerisation|Polymerisation]] geschieht, wobei die Aktivierung durch [[#Radikal|Radikal]]starter ,auch Initiatoren genannt, stattfindet. Diese Iniatoren haben schneller eine Kettenreaktion zur Folge als andere Stoffe. In der heutigen Produktion werden bestimmte preisgünstige {{Anker|Peroxide}}Peroxide (Initiatoren) , die bereits bei niedrigen Temperaturen wirken, zur Produktion von PVC eingesetzt. | ||
<br /> | <br /> | ||
Ein Auschnitt aus dem Aufbau einen Polyvinylchlorids ist in der folgenden Abbildung dargestellt: | Ein Auschnitt aus dem Aufbau einen Polyvinylchlorids ist in der folgenden Abbildung dargestellt: | ||
| − | <popup name= | + | <popup name=Kalottenmodell des Polyvinylchlorids> |
| + | |||
| + | <jmol> | ||
<jmolApplet> | <jmolApplet> | ||
| − | <size> | + | <size>250</size> |
<color>#E6E6E6</color> | <color>#E6E6E6</color> | ||
| − | <uploadedFileContents> | + | <uploadedFileContents>Kalottenmodell von Polyvinylchlorid.cml</uploadedFileContents> |
</jmolApplet> | </jmolApplet> | ||
| − | </jmol> </popup> | + | </jmol> |
| − | + | </popup> | |
| − | + | ===Eigenschaften=== | |
| − | PVC ist ein harter, spröder, weißer armorpher [[#Thermoplast|thermoplastischer]] Kunststoff. Außerdem würde durch stärkere Erwärmung des PVC, Chlorwasserstoff freigesetzt werden, dies wird durch zum Teil giftige Schwermetallverbindungen, die als Stabilisatoren zugesetzt werden, verhindert. | + | PVC ist ein harter, spröder, weißer, armorpher [[#Thermoplast|thermoplastischer]] Kunststoff. Außerdem würde durch stärkere Erwärmung des PVC, Chlorwasserstoff freigesetzt werden, dies wird durch zum Teil giftige Schwermetallverbindungen, die als Stabilisatoren zugesetzt werden, verhindert. Ebenso wird es beim Erhitzen weich und plastisch verformbar, wie bei den meisten [[#Thermoplast|Thermoplasten]]. PVC ist geruchs- und geschmacksfrei, beständig gegen Wasser, gegen viele organische Lösungsmittel und gegen schwache Säuren und Basen. Nachteil ist, dass es eine schlechte elektrische Leitfähigkeit besitzt und sich bei Wärmeeinwirkung langsam zersetzt. Die Dichte beträgt 1,38 und die Druckfestigkeit 55- 90 MPa. Zudem ist es schwer entflammbar. |
{| class="wikitable" | {| class="wikitable" | ||
| Zeile 193: | Zeile 258: | ||
|} | |} | ||
| − | + | ===Anwendung=== | |
PVC wird seit 1913 technisch hergestellt, aber wurde erst in den 50er Jahren zu einem der wichtigsten Kunststoffe des täglichen Gebrauchs. PVC ist sehr vielseitig einsetzbar, das sogenannte Hart-PVC wird für Haushaltsgegenstände, Verpackungsmaterial, Platten, Rohre, Ventile und Hähne verwendet. Wenn man Weichmacher, z.B. Phthalsäureester in Verbindung mit PVC verwendet entsteht Weich-PVC welches zur Herstellung von Schläuchen und Fußbodenbelägen oder Kunstleder verwendet wird. | PVC wird seit 1913 technisch hergestellt, aber wurde erst in den 50er Jahren zu einem der wichtigsten Kunststoffe des täglichen Gebrauchs. PVC ist sehr vielseitig einsetzbar, das sogenannte Hart-PVC wird für Haushaltsgegenstände, Verpackungsmaterial, Platten, Rohre, Ventile und Hähne verwendet. Wenn man Weichmacher, z.B. Phthalsäureester in Verbindung mit PVC verwendet entsteht Weich-PVC welches zur Herstellung von Schläuchen und Fußbodenbelägen oder Kunstleder verwendet wird. | ||
| − | + | ===Probleme=== | |
| − | Im Laufe der Zeit wurde PVC immer weiter verbreitet eingesetzt, allerdings ist PVC durch das Vinylchlorid giftig und Arbeiter, die mit PVC-Produktion in Verbindung standen, wurden krank und anschließend wurde die VC(Vinylchlorid-Krankheit) als Berufskrankheit anerkannt. | + | Im Laufe der Zeit wurde PVC immer weiter verbreitet eingesetzt, allerdings ist PVC durch das Vinylchlorid giftig und Arbeiter, die mit PVC-Produktion in Verbindung standen, wurden krank und anschließend wurde die VC (Vinylchlorid-Krankheit) als Berufskrankheit anerkannt. |
| − | Außerdem könnten Weichmacher entweichen, wenn PVC als Babyspielzeug verwendet wird und die Babys daran lutschen, daher wurde es für diesen Zweck in Deutschland verboten. | + | Außerdem könnten Weichmacher entweichen, wenn PVC als Babyspielzeug verwendet wird und die Babys daran lutschen, daher wurde es für diesen Zweck in Deutschland verboten. Ebenso schlecht steht es für die Entsorgung von PVC, da die Entsorgung ein teurer Prozess ist, der einen Einbau einer Abgasreinigung in Verbrennungsanlagen zur Folge hätte. |
=PUR= | =PUR= | ||
| + | ===Herstellung=== | ||
| − | + | '''''Theorie''''' | |
| − | ''' | + | Polyurethan(PUR) entsteht durch die Polyadditionsreaktion von Polyisocyanaten mit Polyolen. Diese Verknüpfung entsteht durch die Reaktion einer Isocyanatgruppe(-N=C=O) eines Moleküls mit einer Hydroxylgruppe (-OH) eines anderen Moleküls unter Bildung einer Urethangruppe(-NH-CO-O-). Allerdings erfolgen mit der Abspaltung keine Nebenprodukte wie bei der [[#Polykondensation|Polykondensation]]. |
| + | Die Polyurethanbildung erfordert mindestens zwei verschiedene [[#Monomer|Monomere]], am einfachsten ist es mit Diol und Diisocyanat. Die Bildung ensteht in Stufen. Zuerst entsteht aus Diol und Diisocyanat ein bifunktionelles Molekül mit einer Isocyanatgruppe(-N=C=O) und einer Hydroxylgruppe(-OH). | ||
| + | |||
| + | '''''Praxis''''' | ||
| + | |||
| + | In der Praxis gibt es zwei mögliche Wege: | ||
| + | # Die direkte Reaktion eines Polyols mit einem Polyisocyanat(ein Einstufen-Verfahren) | ||
| + | # Herstellen eines funktionalisierten kleineren [[Polymer]]s(sogenanntes Prepolymer) als Zwischenprodukt, was im zweiten Schritt durch Verlinken der funktionellen Gruppe zum gewünschten [[Polymer]] reagiert(ein Zweistufen-Verfahren | ||
| + | |||
| + | ===Eigenschaften=== | ||
| + | |||
| + | Je nach Wahl des Isocyanats und des Polyols kann ein Polyurethan unterschiedliche Eigenschaften aufweisen. Allerdings liegt die Dichte von ungeschäumten PUR zwischen rund 1000 und 1250 kg/m³. | ||
| + | Meistens werden diese Eigenschaften mithilfe der Veränderung der Polyolkomponente verändert, da diese öfter chemisch eingesetzt. | ||
| + | Somit gibt es verschiedene Formen des Polyurethans die im folgenden aufgelistet sind: | ||
| + | *Diphenylmethandiisocyanat (MDI) | ||
| + | *[[Polymer]]es Diphenylmethandiisocyanat (PMDI) | ||
| + | *Toluylendiisocyanat (TDI) | ||
| + | *Naphtylendiisocyanat (NDI) | ||
| + | *Hexamethylendiisocyanat (HDI) | ||
| + | *Isophorondiisocyanat (IPDI) | ||
| + | |||
| + | Wenn Polyurethane ausreagiert sind und keine [[#Monomer|Monomere]] mehr enthalten, sind sie in der Regel nicht mehr gesundheitsschädlich, allerdings können Isocyanate Allergien auslösen und stehen im Verdacht Krebs zu verursachen. | ||
| + | |||
| + | ===Anwendung=== | ||
| + | |||
| + | Polyurethan wird meisten als Füllstoff verwendet, da es eine Schaumartige Struktur hat. | ||
| + | Aus PUR werden Matratzen, Schuhsohlen, Dichtungen, Schläuche, Fußböden, Lacke, Klebstoffe, Dichtstoffe, Skier, Autositze, Laufbahnen in Stadien, Armaturenbretter, Vergussmassen, Kondome(Präservative) und vieles mehr hergestellt. | ||
| + | Ebenso wird bei der Herstellung von modernen Fußbällen Polyurethan als Füllstoff verwendet,auch der äußerste Mantel einer Bowlingkugel besteht aus PUR und noch in vielen anderen Bereichen wird PUR eingesetzt. | ||
| + | |||
| + | = {{Anker|PE}} PE= | ||
| + | |||
| + | ===Herstellung=== | ||
Poly[[Ethen|ethylen]] (PE) wird durch die [[#Polymerisation|Polymerisation]] von [[Ethen]] hergestellt. Daher hat es die vereinfachte Strukturformel (-H2C-CH2-). Je nach Druck entstehen verschiedene Arten des Poly[[Ethen|ethylen]]: | Poly[[Ethen|ethylen]] (PE) wird durch die [[#Polymerisation|Polymerisation]] von [[Ethen]] hergestellt. Daher hat es die vereinfachte Strukturformel (-H2C-CH2-). Je nach Druck entstehen verschiedene Arten des Poly[[Ethen|ethylen]]: | ||
Beim Hochdruckverfahren das Weich-Poly[[Ethen|ethylen]] (PE-LD), im Niederdruckverfahren das Hart-Poly[[Ethen|ethylen]] (PE-HD). Bei beiden Verfahren ist das Poly[[Ethen|ethylen]] zunächst eine zähe Flüssigkeit, allerdings werden im Niederdruckverfahren geträgerte Katalysatoren eingesetzt und somit fällt das Poly[[Ethen|ethylen]] in Form fester Körner an. | Beim Hochdruckverfahren das Weich-Poly[[Ethen|ethylen]] (PE-LD), im Niederdruckverfahren das Hart-Poly[[Ethen|ethylen]] (PE-HD). Bei beiden Verfahren ist das Poly[[Ethen|ethylen]] zunächst eine zähe Flüssigkeit, allerdings werden im Niederdruckverfahren geträgerte Katalysatoren eingesetzt und somit fällt das Poly[[Ethen|ethylen]] in Form fester Körner an. | ||
| − | + | ===Eigenschaften=== | |
| − | + | ||
*niedrige Dichte(0,87-0,965 g/cm³) | *niedrige Dichte(0,87-0,965 g/cm³) | ||
| Zeile 222: | Zeile 318: | ||
*geringe Wasseraufnahme | *geringe Wasseraufnahme | ||
| − | =Hydrolyse= | + | ===Anwendung=== |
| + | |||
| + | *PE-LD und PE-LLD werden vorallem in der Folienproduktion eingesetzt => Müllsäcke,Schrumpffolien und Landwirtschaftsfolien werden damit hergestellt | ||
| + | *PE-HD wird zum Herstellen von Hohlkörpern benutzt => Flaschen für Haushaltsreinigungsmittel und auch großvolumige Behälter mit bis zu 1000 l. Außerdem wird es für Wasserbau- und Deponiebaufolien verwendet. Ein weiteres großes Einsatzgebiet ist die Gas- und Trinkwasserversorgung | ||
| + | *PE-UHMW wird für Pumpenteile, Zahnräder, Gleitbuchsen, Implantate und Oberflächen von Endoprothesen verwendet. PE-UHMW gehört zu einem der stärksten bekannten künstlichen Fasern, welches als Material für einen Weltraumlift im Gespräch sind | ||
| + | |||
| + | = {{Anker|Recycling}} Recycling= | ||
| + | Unter dem Begriff „Recycling“ versteht man die Aufbereitung und Wiederverwendung von Abfällen, aus denen neue Produkte hergestellt werden. Die Abfälle werden dabei zunächst in neue Rohstoffe verwandelt. Es können aber nicht alle Abfälle recycelt werden, denn dies ist nur mit Produkten möglich, die wiederverwendbar sind. Gekennzeichnet sind diese durch ein grünes Logo auf dem Produkt. Zudem gibt es drei unterschiedliche Verfahren des Recyclings der [[#Thermoplast|Thermoplaste]]. Man bezeichnet sie als werkstoffliche Verwertung, rohstoffliche Verwertung und energetische Verwertung. Unter der werkstofflichen Verwertung versteht man die Aufbereitung von bereits verwendeten Kunststoffen, bei der die Struktur unverändert bleibt. Hier werden die einzelnen Teile gereinigt, zerkleinert und nach ihren Sorten getrennt. | ||
| + | Die rohstoffliche Verwertung beschreibt die Spaltung der [[Polymer|Polymer]]ketten. Dies wird beispielsweise durch das Einwirken von Wärme erreicht. Besonderes eignet sich diese Methode für verschmutze, sowie für vermischte Kunststoffreaktionen. Die energetische Verwertung beschreibt die Rückgewinnung der Energie, die in den Kunststoffen enthalten ist. Erreicht wird dies durch die Verbrennung der Kunststoffe, wobei die entstehende Energie gleichzeitig für die Stromerzeugung oder ähnliches benutzt wird. Diese Form der Verwertung eignet sich ebenfalls besonders für verschmutze und vermischte Kunststoffreaktionen, zusätzlich aber auch für schadstoffbelastete. | ||
| + | |||
| + | ===Pyrolyse=== | ||
| + | Bei der Pyrolyse werden [[#Thermoplast|Thermoplasten]] in ihre [[Polymer]]e durch Hitzeeinwirkung zerlegt. Dieser Vorgang ist eine Erhitzung, bei der allerdings keinerlei Sauerstoff bzw. Luft hinzugefügt wird. Dies wird durch ein Verfahren namens "Vergasung", bei welchem stark erhitztes Gas in die eine Kammer mit dem [[#Thermoplast|Thermoplast]] gepumpt wird. Dabei werden hohe Temperaturen erzielt, welche nötig sind, da die [[#Thermoplast|Thermoplasten]] nicht nur neugeformt werden sollen, sondern die einzelnen [[Polymer]]- Stränge losgelöst werden sollen. | ||
| + | |||
| + | === Hydrolyse === | ||
| + | Als Hydrolyse bezeichnet man die Spaltung von einer Verbindung, durch eine Reaktion mit Wasser. | ||
| + | Die Reaktionsgleichung lautet hierbei: | ||
| + | Spaltrest 1 + Wasseratom --> Spaltrest 2 + Hydroxylrest | ||
| + | |||
| + | ===Recycling-Code=== | ||
| + | Der Recycling-Code dient der einfachen Identifizierung von chemischen Stoffen. Im Bezug auf Kunststoffe zeigt es auf, welche Stoffe wie recycelt werden können und ob die Kunststoffe potenziell gefährlich sind. | ||
| + | *Kunststoffe der ersten Recycling Klasse [[#PET|PET(E)]] werden häufig in Trinkflaschen und Folien genutzt. Sie werden zu Dingen wie Fleecejacken und Surfbrettern recycelt. | ||
| + | *Kunststoffe der zweiten Recycling Klasse HDPE werden in Saft-,Milch- und Wasserflaschen genutzt, des Weiteren auch in Tragetaschen und Plastikrohren. Recycelt werden sie zu Dingen wie Picknicktischen. | ||
| + | *Kunststoffe der dritten Recycling Klasse [[#PVC|PVC]] ,oder auch nur V genannt, werden für die Herstellung von Spülmittelflaschen und Kunststoff-Rohren genutzt. Die Recycling Produkte sind meistens Objekte wie Geländer oder Rohre. | ||
| + | *Kunststoffe der vierten Recycling Klasse LDPE werden genutzt, um Plastik-, Obst-, und Brötchentüten herzustellen. In diese können sie dann auch einfach wieder recycelt werden. | ||
| + | *Kunststoffe der fünften Recycling Klasse PP werden für stabile Kunststoffprodukte wie Dachverkleidungen oder Stoßstangen-Puffer gebraucht. Sie sind auch in dingen wie Strohalmen und Senftuben zu finden. Sie sind schwer zu recyclen, können allerdings manchmal für die Herstellung von Autobatterie-Kästen genutzt werden. | ||
| + | *Kunststoffe der sechsten Recycling Klasse PS, auch bekannt als Styropor, werden vornehmlich eingesetzt als Dichtungen und können zu Spielzeug und Koffern recycelt werden. | ||
| + | *Kunststoffe der siebten Recycling Klasse OTHER oder auch nur O werden bei verschiedenen Flaschen wie Ketchup-, Senf- oder Saft-Flaschen genutzt. Sie sind schwer zu recyclen, da sie aus vielen verschiedenen Kunststoff schichten Bestehen, allerdings können manche zu Parkbänken etc. recycelt werden. | ||
| + | |||
| + | ===Energetische Verwertung=== | ||
| + | Falls ein Stoff nicht mehr weiter recycelt wird, wird er energetisch verwertet. Der Stoff wird in einer Müllverbrennungsanlage verbrannt und wird zur Strom- und Wärmegewinnung genutzt. Recyclen wird der energetischen Verwertung immer vorgezogen. | ||
| + | |||
| + | = Versuche = | ||
| + | === 1. Versuch: === | ||
| + | |||
| + | '''Herstellen von Polystyrol''' | ||
| + | |||
| + | Intention: Anwendungsbeispiel für eine Polymerisationsreaktion | ||
| + | |||
| + | Geräte: Reagenzglas, Glasstab, Wasserbad, Dreifuß, Bunsenbrenner | ||
| + | |||
| + | Chemikalien: Styrol (mindergiftig), Cumolhydroperoxid (ätzend,brandfördernd) | ||
| + | |||
| + | Durchführung:In ein Reagenzglas geben Sie 10 ml Styrol und vermischen es gut mit 1 ml Cumolhydroperoxid. Das Reagenzglas stellen Sie in ein Becherglas mit siedendem Wasser. Sobald sich die Viskosität verändert entnimmt man das Reagenzglas und lässt es Abkühlen. | ||
| + | |||
| + | Beobachtung: Was verändert sich im Hinblick auf die Viskosität? | ||
| + | ::::Was für ein Produkt entsteht? | ||
| + | Formulieren Sie die im Versuch zu erkennenden Reaktionsschritte und erklären Sie den Reaktionsmechanismus in den einzelnen Phasen. | ||
| + | <popup name= Deutungshilfe> Bei der Reaktion von monomeren Styrolmolekülen zu Polystyrol handelt es sich um eine radikalische Polymerisation. Cumolhydroperoxid ist hierbei der Initiator für die Reaktion. Es bildet in der Hitze Radikale. Ein solches Radikal lagert sich an ein Styrolmolekül an und erzeugt dabei durch Elektronenverschiebung ein neues Radikal, welches sich wiederum an ein Styrolmolekül anlagert. Daraus entstehen immer größere Radikale, bis keine Styrolmoleküle mehr vorhanden sind oder zwei Radikale aufeinandertreffen. Bei der Reaktion ist also ein harter, spröder Brocken Polystyrol entstanden. </popup> | ||
| + | === 2. Versuch === | ||
| − | + | ''' Recycling von Kunststoffen durch Umschmelzen''' | |
| + | Intention: Die Bedeutung des Recycling von Kunststoffen darzustellen. | ||
| − | + | Geräte: Bunsenbrenner, Dreifuß mit Drahtnetz, Metall-Ausstechform für Gebäck, Aluminiumfolie, Schere | |
| + | Chemikalien: [[#PE|Polyethen]], Polypropen (z.B Spülmittelflaschen) | ||
| − | + | Durchführung: Alte Spülmittelflaschen und deren Verschlüsse bestehen oft aus [[#PE|Polyethen]] (Flasche) und Polypropen (Verschluss). Diese werden gereinigt und mit einer Schere in kleine Stücke geschnitten. Zwei Ausstechformen werden doppelt mit Aluminiumfolie ausgekleidet. In diese füllt man jeweils Stücke von [[#PE|Polyethen]] und Polypropen mit einer Schichtdicke von 0,5 cm. Anschließend erhitzt man mit dem Bunsenbrenner. | |
=Quellen= | =Quellen= | ||
| − | https://de.wikipedia.org/wiki/Monomer | + | #https://de.wikipedia.org/wiki/Monomer |
| − | Chemie Buch: elemente chemie 2 (Seite 306 ff.) | + | #Chemie Buch: elemente chemie 2 (Seite 306 ff.) |
| − | https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/polyvinylchlorid-pvc | + | #https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/polyvinylchlorid-pvc |
| − | https://www.chemie.de/lexikon/Polyethylen.html | + | #https://www.chemie.de/lexikon/Polyethylen.html |
| − | https://www.plasticseurope.org/de/focus-areas/circular-economy/zero-plastics-landfill/recycling-and-energy-recovery | + | #https://www.plasticseurope.org/de/focus-areas/circular-economy/zero-plastics-landfill/recycling-and-energy-recovery |
| + | #https://www.kunststoffe.de/themen/basics/technische-kunststoffe/polyamide-pa/artikel/polyamide-pa-651963 | ||
| + | #https://www.internetchemie.info/chemie-lexikon/funktionelle-gruppen/p/peptid-bindung.php | ||
| + | #https://www.alba.info/unternehmen/service/glossar/energetische-verwertung.html | ||
| + | #http://www.all-recycling.de/hausmuell-recyceln/plastik-recycling-code.html | ||
| + | #http://chemie-digital.zum.de/wiki/Frau_Lachner/Oberstufe_neu/Grundlagen_der_Polymer-Chemie | ||
| + | #http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/12/oc/vlu_organik/radikale/radikale_einfuehrung.vlu/Page/vsc/de/ch/12/oc/radikale/radikalreaktionen/radikalreaktionen.vscml.html | ||
| + | #http://www.chemieunterricht.de/dc2/auto/a-v-kst9.htm | ||
| + | #http://www.chemieunterricht.de/dc2/haus/v126.htm | ||
| + | #https://www.youtube.com/user/TheSimpleChemics | ||
Aktuelle Version vom 12. November 2018, 23:33 Uhr
Gruppe von Lena, Paulina, Daniel, Alexander, Laura und Lea!
Kaum ein Tag vergeht an dem wir nicht mit Kunststoffen in Kontakt treten. In unserer modernen Welt sind sie ein beliebter Werkstoff, welcher vielfältig eingesetzt wird, zum Beispiel in der Fahrzeug- oder der Textilindustrie. Doch Kunststoff ist nicht gleich Kunststoff. Verschiedene Bedürfnisse benötigen verschiedene Eigenschaften. Für den Einsatzbereich entscheidend sind Eigenschaften wie Temperaturbeständigkeit, Verformbarkeit und Elastizität. Es ergeben sich die drei Gruppen: Thermoplaste, Duroplaste und Elastomere.
Inhaltsverzeichnis |
Makromoleküle
Makromoleküle sind meistens Polymere und werden umgangssprachlich auch als „Riesenmolekül“ bezeichnet, da es sich um sehr große Moleküle handelt. Sie bestehen aus sich wiederholenden, gleichen oder unterschiedlichen Atomen oder Atomgruppen, die aus Monomere gebildet werden. Durch ihre Größe hat eine Wegnahme oder Aufnahme von Atomen keinen Einfluss auf die Eigenschaften. Ein Beispiel für synthetische Makromoleküle sind zum Beispiel Kunststoffe.
Monomere
Moleküle aus denen Makromoleküle gebildet werden nennt man Monomere. "Monomeres" ist griechisch für einfach und einteilig, was gut die Funktion des Monomers beschreibt, denn es ist die kleinste Einheit, welche immer wiederkehrt. Durch Polymerisation, Polykondensation oder Polyaddition reagieren sie zu Polymeren (Makromolekülen). Man unterscheidet zwischen Homopolymeren und Copolymeren, letztere sind Polymere aus unterschiedlichen Monomeren. Bei Homopolymeren wird ausschließlich eine Monomer-Art benutzt. Aufgebaut sind Monomere meist durch eine C=C Doppelbindung, allerdings sind auch weitere Moleküle denkbar - wichtig sind mindestens zwei funktionelle Gruppen pro Molekül. Ein bekanntes Beispiel ist das Ethen (Ethylen), es wird für Tragetaschen, Eimer und Mülltonnen benutzt.
Thermoplast
Thermoplaste sind Kunststoffe, die bei einer bestimmten Temperatur verformbar sind. Das Wort Thermoplaste lässt sich in zwei Teile aufteilen: "Thermo" steht für Wärme und "Plasten" bedeutet formen. Bei niedrigen Temperaturen sind die Kunststoffe fest. Erwärmt man den Stoff gelangt er zunächst in den thermoelastischen Bereich, indem der Stoff verformbar ist, aber anschließend wieder seine ursprüngliche Form annimmt (bspw. ein Schwamm bei Raumtemperatur) . Wenn man den Kunststoff noch weiter erhitzt, gelangt man in den thermoplastischen Bereich, wo der Stoff ebenfalls verformbar ist, aber im Gegensatz zum anderen Bereich, nicht mehr in seine Ursprungsform zurückgeht. Zuletzt kann man die Kunststoffe so weit erhitzen, bis sie flüssig werden und sich schlussendlich zersetzen. Die Grundstruktur eines Thermoplasts besteht aus mehreren nebeneinander verlaufenden Ketten (Polymeren), welche untereinander nicht vernetzt sind. Diese sind für die thermoplastische Eigenschaft verantwortlich. Somit gilt: Je höher die Temperatur ist, desto besser können die einzeln vorliegenden Polymeren (lineare/strauchähnlich verzweigte Makromoleküle) gegeneinander verschoben werden. Die Verschiebung wiederum ist für die Elastizität notwendig. Man unterscheidet hier zwischen zwei Bereichen. In dem kristallinen Bereich (1. Abb.) liegen die Ketten geordnet nebeneinander vor und im amorphen Bereich (2. Abb.) liegen die einzelnen Ketten ungeordnet und verknäult vor. Je mehr kristalline Bereiche es gibt, desto härter und spröder ist ein Thermoplast.
Zur Veranschaulichung der verschiedenen Bereiche dient dieses Video
Duroplast
Als Duroplasten bezeichnet man einen sehr harten, stabilen Kunststoff. Er wird aus Monomeren durch Polykondensation künstlich zusammengesetzt. Durch Atombindungen sind Molekülketten engmaschig 3D verknüpft und daher nur wenig beweglich (Abbildung). Es bestehen mindestens 2-3 Bindungen und somit werden auch mehr als 2 funktionelle Gruppen benötigt. Anders als Thermoplaste sind Duroplaste nicht schmelzbar und nicht durch Lösemittel auflösbar. Bei Hitze zersetzten sie sich lediglich, denn ihre Atombindungen werden gespalten. Allerdings sind Duroplasten, im Gegensatz zu Elastomere, hart, spröde und können zerbrechen. Aufgrund ihrer Eigenschaften werden sie oft in Computern oder auch Autos verbaut, denn sie sind hitzebeständig, sehr stabil und nicht verformbar.
Elastomer
Die Elastomere gehören zu den Kunststoffen. Sie unterscheiden sich jedoch von den anderen Kunststoffen, wie den Thermoplasten und den Duroplasten, besonders durch ihre hohe Elastizität. Daher werden diese Kunststoffe umgangssprachlich auch als „Gummi“ bezeichnet. Ein Beispiel für ein Elastomer wäre somit ein Schwamm oder auch ein Autoreifen. Die Elastomere bestehen aus kleinen organischen Einheiten, diese werden auch als Monomer bezeichnet. Durch Vorgänge wie die Polymerisation, Polyaddition und Polykondensation werden sie künstlich zusammengeknüpft und liegen anschießend „verknäult“ vor.Eine Besonderheit bei den Elastomeren ist, dass sie durch Kälte spröde werden. Zu einer Zersetzung kommt es jedoch erst ab ca. 300 Grad Celcius. Außerdem lassen sich Elastomere durch Druck bzw. Zug verformen, gehen anschließend aber wieder ihre Ausgangsform zurück. Dabei speichern sie zudem keine Energie. Ein weiteres Merkmal ist die schlechte Löslichkeit der Elastomere, da sie nicht schmelzbar sind und sich auch nicht in Lösungsmittel auflösen. Dies lässt sich auf die weitmaschige 2D Verknüpfung der Monomere zurückführen.
Polymerisation
Es gibt verschiedene Möglichkeiten Kunststoffe herzustellen. Man unterscheidet bei den Reaktionsarten zwischen der Polykondensation, der Polyaddition und der Polymerisation. Das verwendete Monomer bestimmt hierbei die Reaktionsart. Die Polymerisation läuft ab wenn mindestens eine C=C Doppelbindung vorliegt. Dies ist entscheidend für den weiteren Verlauf der Reaktion, denn bei dieser brechen Doppelbindungen auf und die verschiedenen Monomermoleküle verbinden sich unter Ausbildung von C-C Einfachbindungen. Liegt nur eine Doppelbindung vor entstehen lange, unverzweigte Ketten. Dieses Verfahren stellt Thermoplasten her.
Radikale
Radikale sind Atome oder Moleküle, die mindestens ein ungepaartes Valenzelektron besitzen. Valenzelektronen bestimmen die Wertigkeit eines Moleküls und sind für die chemische Bindung verantwortlich. Wegen des ungepaarten Elektrons handelt es sich hierbei um hochreaktive und wenig stabile Moleküle. Deswegen existieren Radikale meist nur sehr kurze Zeit (< 1 Sekunde); eine Ausnahme dabei stellen stabilisierte Radikale dar. Radikale werden mit einem Punkt dargestellt. Ein typisches Merkmal für Radikale ist es, dass sie häufig in Form einer Kettenreaktion reagieren.
Radikalketten-Mechanismus
Das Grundprinzip aller Herstellungsverfahren künstlicher Polymere ist die Herstellung eines Makromoleküls aus den Monomeren. Die einfachste Form, um ein Makromolekül herzustellen, ist die sogenannte Kettenpolymerisation. Diese umfasst alle chemischen Reaktionen, bei denen sich fortlaufend gleiche oder unterschiedliche Monomere an ein wachsendes Polymer zusammensetzen. Bei der Polykondensation spalten sich kleine Moleküle ab und bei der Polyaddition gruppieren sich diese um, sodass man diese Verfahren nicht zu der Polymerisation dazuzählen darf. Die radikalische Polymerisation ist unempfindlich, leicht von außen durch Zusatzstoffe zu steuern und zu kontrollieren und sie liefert schon bei recht kleinen Umsätzen hohe Polymerisationsgrade. Der Polymerisationsgrad beschreibt die Zahl der Monomere, aus denen das Polymer letztendlich besteht. Der Mechanismus wird hauptsächlich für billigere Kunststoffe wie PVC, PS oder PE eingesetzt. Ein Reaktionsmechanismus beschreibt im Allgemeinen einen Prozess, der von Edukten bis Produkten ähnlich verläuft und von Elektronenbewegungen geprägt ist. Bei der radikalischen Polymerisation werden bestimmte Zwischenstufen immer wieder durchlaufen und die Edukte werden in einem kontinuierlichen Kreisprozess in Produkte umgewandelt. Die radikalische Polymerisation beruht im Wesentlichen auf drei Teilschritten:
1.Startreaktion
Eine Polymerisationsreaktion muss durch Startmoleküle (Initiatoren) in Gang gesetzt werden, das heißt zu Beginn müssen Startradikale erzeugt werden. Diese werden meist aus organischen Peroxiden hergestellt, da diese instabile Moleküle darstellen und deswegen leicht irreversibel zerfallen. Das entstehende Startradikal spaltet die Doppelbindung eines Monomermoleküls auf und eine Umlagerung von Elektronen findet statt. Dadurch entsteht ein "verlängertes" Radikal.
2. Wachstumsreaktion
Das in der Startreaktion entstandene Radikal reagiert mit einem weiteren Monomermolekül unter Kettenverlängerung. Es lagern sich nun also wiederholend neue Monomere an, ohne dass dabei eine weitere Zufuhr von Aktivierungsenergie nötig ist, da diese Reaktion stark exotherm ist. Durch die freiwerdende Polymerisationswärme werden weitere Radikale erzeugt, sodass die Reaktion sich selbst beschleunigen kann, was im Extremfall zu einer Überlastung des Reaktionsmaterials und somit zu einer thermischen Explosion führen kann. Diese in Form von Wärme auftretende Energie muss also abgeführt werden, um die Zersetzung des Makromoleküls zu vermeiden. Die Wachstumsreaktion verläuft genauso wie die Startreaktion nur deutlich öfter.
3. Abbruchreaktion
Die Wachstumsreaktion setzt sich so lange fort, bis zwei Radikale miteinander reagieren und somit einen Kettenabbruch bewirken, denn beide Moleküle bilden dann eine Elektronenpaarbindung zueinander aus.
Es gibt hierbei eine 2. Möglichkeit, dass die radikalische Polymerisation abbricht: Innerhalb eines Radikals kann sich ebenfalls eine Doppelbindung ausbreiten, sodass ein Wasserstoff-Radikal entsteht. Dieses bindet sich an ein anderes Radikal.
Peptid-Gruppen
Die Peptid-Gruppe ist eine (C=O)-(NH)-Gruppe, welche zwei Aminosäuren miteinander verbindet. Dies ist die Bindung zwischen der Carboxylgruppe einer Aminosäure und der Aminogruppe einer zweiten Aminosäure.
Polyamid
Polyamide zählen zu den wichtigsten technischen Thermoplasten. Sie sind zähe Materialien mit einer hohen Festigkeit und haben eine gute Abriebs- und Verschleißfestigkeit. Außerdem können sie relativ viel Wasser aufnehmen, sind polar und nur gegenüber starken Säuren unbeständig. Die Polyamide ersetzen viele Metallteile im Fahrzeugbau, da sie eine deutlich höhere Wärmeformbeständigkeit und eine gute Beständigkeit gegenüber organischen Lösungsmitteln aufweisen. Außerdem leiten sich fast alle Polyamide von primären Aminen ab. Die funktionelle Gruppe der sich wiederholenden Einheit ist hier (C=O)-(NH).
PET
Herstellung
Polyethylenterephthalat (PET) ist ein durch Polykondensation hergestellter thermoplastischer Kunststoff aus der Familie der Polyester. PET wird aus Monomeren hergestellt, diese sind Terephtalsäure und Ethylenglykol. In neueren Verfahren wird Ethandiol mit Terephthalsäure direkt verestert.
Eigenschaften
| PET | Summenformel | Dichte | Schmelzpunkt | Löslichkeit |
|---|---|---|---|---|
| PET | C10H8O4 | 1,3 | >250°C | praktisch unlöslich in Wasser |
Anwendung
Ein sehr großes Anwendungsgebiet für PET sind die Polyesterfolien, die heute in Dicken von 1 bis 500 Mikrometern hergestellt werden. Ihre Anwendung geht über Dünnstfolien für Wickelkondensatoren, Schreibmaschinenbänder, Prägefolien, Verpackungsfolien für aromadichte Verpackungen, Möbelfolien, eingefärbte Lichtschutzfolien, Fotofilm, Röntgenfilm, Elektroisolierfolie, Ankernutisolierfolie bis zur Folie für Teststreifen in der pharmazeutischen Industrie. Ein großes Anwendungsgebiet waren auch Trägerfolien für Audio- und Videobänder.
Eines der bekanntesten Anwendungsgebiete für PET ist die Herstellung von PET-Flaschen aller Art und die Verarbeitung zu Textilfasern. Auch zur Herstellung alter Filmrollen wurde PET verwendet.
Zum Recycling des PET wurde ein Verfahren entwickelt, welches 2010 für den Deutschen Zukunftspreis nominiert wurde, bei der das PET der Flaschen sorgfältig in ihre Einzelteile zerlegt wird. Im Jahr 2009 wurden europaweit 48,4% aller PET-Flaschen für das Recycling gesammelt und der Rest wurde verarbeitet.
PVC
Herstellung
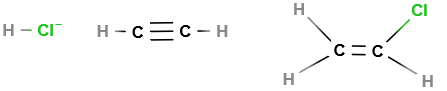
Polyvinylchlorid (PVC) wird durch eine radikalische oder ionische Kettenpolimerisation aus dem Monomer Vinylchlorid (CH² = CHCl) erzeugt. Um es herzustellen, kann man zum einen Ethin und zum anderen Ethen verwenden. Bei der ersten Möglichkeit findet die Reaktion zwischen Chlorwasserstoff(HCl) mit Ethin statt.
Wenn eine Temperatur von 200°C gegeben ist und es unter Druck steht wird Chlorwasserstoff and die Dreifachbindung des Ethins addiert und bildet somit Vinylchlorid. Außerdem muss Quecksilber(II)chlorid als Katalysator vorhanden sein.
Diese Reaktion ist in dem vorliegenden Bild: Herstellung eines Vinylchlorids dargestellt:
| Vinylchloridreaktion | Beschreibung der Reaktion |
|---|---|
|
Am Anfang der Reaktion sind Ethin (H-C=C-H) und Chlorwasserstoff (HCl) vorhanden. Diese werden durch Addition zu Chlorethen (Vinylchlorid). Allerdings ist dieses Verfahren veraltet und heutzutage wird Chlor und Ethen addiert, wodurch Dichlorethan entsteht, welches mithilfe eines Aluminiumoxid-Katalysators unter Abspaltung von Chlorwasserstoff(HCl) zu Vinylchlorid umgewandelt wird. Nachdem das giftige Vinylchlorid hergestellt wurde wird es durch Zugabe der Peroxide in der Ketten-Polymerisation zu festem Polyvinylchlorid. Somit erhält man Polyvinylchlorid, wenn man mindestens 2 Monomere Vinylchlorid miteinander polymerisiert. |
Den Verlauf der Polymerisation nochmals allgemeiner erläutert bedeutet, dass es durch eine radikale Polymerisation geschieht, wobei die Aktivierung durch Radikalstarter ,auch Initiatoren genannt, stattfindet. Diese Iniatoren haben schneller eine Kettenreaktion zur Folge als andere Stoffe. In der heutigen Produktion werden bestimmte preisgünstige Peroxide (Initiatoren) , die bereits bei niedrigen Temperaturen wirken, zur Produktion von PVC eingesetzt.
Ein Auschnitt aus dem Aufbau einen Polyvinylchlorids ist in der folgenden Abbildung dargestellt:
Eigenschaften
PVC ist ein harter, spröder, weißer, armorpher thermoplastischer Kunststoff. Außerdem würde durch stärkere Erwärmung des PVC, Chlorwasserstoff freigesetzt werden, dies wird durch zum Teil giftige Schwermetallverbindungen, die als Stabilisatoren zugesetzt werden, verhindert. Ebenso wird es beim Erhitzen weich und plastisch verformbar, wie bei den meisten Thermoplasten. PVC ist geruchs- und geschmacksfrei, beständig gegen Wasser, gegen viele organische Lösungsmittel und gegen schwache Säuren und Basen. Nachteil ist, dass es eine schlechte elektrische Leitfähigkeit besitzt und sich bei Wärmeeinwirkung langsam zersetzt. Die Dichte beträgt 1,38 und die Druckfestigkeit 55- 90 MPa. Zudem ist es schwer entflammbar.
| PVC | Dichte | Druckfestigkeit | Hitze | Sinneseindrücke | Beständigkeit gegen | Sonstiges |
|---|---|---|---|---|---|---|
| PVC | 1,38 | 55-90 MPa | Schwer entflammbar, wird weich und verformbar | Ist geruchs und geschmackslos | Wasser, organische Lösungsmittel, schwache Säuren/Basen | Schlechte elektische Leitfähigkeit und langsame Wärmeeinwirkung |
Anwendung
PVC wird seit 1913 technisch hergestellt, aber wurde erst in den 50er Jahren zu einem der wichtigsten Kunststoffe des täglichen Gebrauchs. PVC ist sehr vielseitig einsetzbar, das sogenannte Hart-PVC wird für Haushaltsgegenstände, Verpackungsmaterial, Platten, Rohre, Ventile und Hähne verwendet. Wenn man Weichmacher, z.B. Phthalsäureester in Verbindung mit PVC verwendet entsteht Weich-PVC welches zur Herstellung von Schläuchen und Fußbodenbelägen oder Kunstleder verwendet wird.
Probleme
Im Laufe der Zeit wurde PVC immer weiter verbreitet eingesetzt, allerdings ist PVC durch das Vinylchlorid giftig und Arbeiter, die mit PVC-Produktion in Verbindung standen, wurden krank und anschließend wurde die VC (Vinylchlorid-Krankheit) als Berufskrankheit anerkannt. Außerdem könnten Weichmacher entweichen, wenn PVC als Babyspielzeug verwendet wird und die Babys daran lutschen, daher wurde es für diesen Zweck in Deutschland verboten. Ebenso schlecht steht es für die Entsorgung von PVC, da die Entsorgung ein teurer Prozess ist, der einen Einbau einer Abgasreinigung in Verbrennungsanlagen zur Folge hätte.
PUR
Herstellung
Theorie
Polyurethan(PUR) entsteht durch die Polyadditionsreaktion von Polyisocyanaten mit Polyolen. Diese Verknüpfung entsteht durch die Reaktion einer Isocyanatgruppe(-N=C=O) eines Moleküls mit einer Hydroxylgruppe (-OH) eines anderen Moleküls unter Bildung einer Urethangruppe(-NH-CO-O-). Allerdings erfolgen mit der Abspaltung keine Nebenprodukte wie bei der Polykondensation. Die Polyurethanbildung erfordert mindestens zwei verschiedene Monomere, am einfachsten ist es mit Diol und Diisocyanat. Die Bildung ensteht in Stufen. Zuerst entsteht aus Diol und Diisocyanat ein bifunktionelles Molekül mit einer Isocyanatgruppe(-N=C=O) und einer Hydroxylgruppe(-OH).
Praxis
In der Praxis gibt es zwei mögliche Wege:
- Die direkte Reaktion eines Polyols mit einem Polyisocyanat(ein Einstufen-Verfahren)
- Herstellen eines funktionalisierten kleineren Polymers(sogenanntes Prepolymer) als Zwischenprodukt, was im zweiten Schritt durch Verlinken der funktionellen Gruppe zum gewünschten Polymer reagiert(ein Zweistufen-Verfahren
Eigenschaften
Je nach Wahl des Isocyanats und des Polyols kann ein Polyurethan unterschiedliche Eigenschaften aufweisen. Allerdings liegt die Dichte von ungeschäumten PUR zwischen rund 1000 und 1250 kg/m³. Meistens werden diese Eigenschaften mithilfe der Veränderung der Polyolkomponente verändert, da diese öfter chemisch eingesetzt. Somit gibt es verschiedene Formen des Polyurethans die im folgenden aufgelistet sind:
- Diphenylmethandiisocyanat (MDI)
- Polymeres Diphenylmethandiisocyanat (PMDI)
- Toluylendiisocyanat (TDI)
- Naphtylendiisocyanat (NDI)
- Hexamethylendiisocyanat (HDI)
- Isophorondiisocyanat (IPDI)
Wenn Polyurethane ausreagiert sind und keine Monomere mehr enthalten, sind sie in der Regel nicht mehr gesundheitsschädlich, allerdings können Isocyanate Allergien auslösen und stehen im Verdacht Krebs zu verursachen.
Anwendung
Polyurethan wird meisten als Füllstoff verwendet, da es eine Schaumartige Struktur hat. Aus PUR werden Matratzen, Schuhsohlen, Dichtungen, Schläuche, Fußböden, Lacke, Klebstoffe, Dichtstoffe, Skier, Autositze, Laufbahnen in Stadien, Armaturenbretter, Vergussmassen, Kondome(Präservative) und vieles mehr hergestellt. Ebenso wird bei der Herstellung von modernen Fußbällen Polyurethan als Füllstoff verwendet,auch der äußerste Mantel einer Bowlingkugel besteht aus PUR und noch in vielen anderen Bereichen wird PUR eingesetzt.
PE
Herstellung
Polyethylen (PE) wird durch die Polymerisation von Ethen hergestellt. Daher hat es die vereinfachte Strukturformel (-H2C-CH2-). Je nach Druck entstehen verschiedene Arten des Polyethylen: Beim Hochdruckverfahren das Weich-Polyethylen (PE-LD), im Niederdruckverfahren das Hart-Polyethylen (PE-HD). Bei beiden Verfahren ist das Polyethylen zunächst eine zähe Flüssigkeit, allerdings werden im Niederdruckverfahren geträgerte Katalysatoren eingesetzt und somit fällt das Polyethylen in Form fester Körner an.
Eigenschaften
- niedrige Dichte(0,87-0,965 g/cm³)
- hohe Zähigkeit und Reißdehnung
- positives Gleitverhalten, geringer Verschleiß
- optisch milchig weiß
- sehr gutes elektrische und dielektrisches Verhalten
- geringe Wasseraufnahme
Anwendung
- PE-LD und PE-LLD werden vorallem in der Folienproduktion eingesetzt => Müllsäcke,Schrumpffolien und Landwirtschaftsfolien werden damit hergestellt
- PE-HD wird zum Herstellen von Hohlkörpern benutzt => Flaschen für Haushaltsreinigungsmittel und auch großvolumige Behälter mit bis zu 1000 l. Außerdem wird es für Wasserbau- und Deponiebaufolien verwendet. Ein weiteres großes Einsatzgebiet ist die Gas- und Trinkwasserversorgung
- PE-UHMW wird für Pumpenteile, Zahnräder, Gleitbuchsen, Implantate und Oberflächen von Endoprothesen verwendet. PE-UHMW gehört zu einem der stärksten bekannten künstlichen Fasern, welches als Material für einen Weltraumlift im Gespräch sind
Recycling
Unter dem Begriff „Recycling“ versteht man die Aufbereitung und Wiederverwendung von Abfällen, aus denen neue Produkte hergestellt werden. Die Abfälle werden dabei zunächst in neue Rohstoffe verwandelt. Es können aber nicht alle Abfälle recycelt werden, denn dies ist nur mit Produkten möglich, die wiederverwendbar sind. Gekennzeichnet sind diese durch ein grünes Logo auf dem Produkt. Zudem gibt es drei unterschiedliche Verfahren des Recyclings der Thermoplaste. Man bezeichnet sie als werkstoffliche Verwertung, rohstoffliche Verwertung und energetische Verwertung. Unter der werkstofflichen Verwertung versteht man die Aufbereitung von bereits verwendeten Kunststoffen, bei der die Struktur unverändert bleibt. Hier werden die einzelnen Teile gereinigt, zerkleinert und nach ihren Sorten getrennt. Die rohstoffliche Verwertung beschreibt die Spaltung der Polymerketten. Dies wird beispielsweise durch das Einwirken von Wärme erreicht. Besonderes eignet sich diese Methode für verschmutze, sowie für vermischte Kunststoffreaktionen. Die energetische Verwertung beschreibt die Rückgewinnung der Energie, die in den Kunststoffen enthalten ist. Erreicht wird dies durch die Verbrennung der Kunststoffe, wobei die entstehende Energie gleichzeitig für die Stromerzeugung oder ähnliches benutzt wird. Diese Form der Verwertung eignet sich ebenfalls besonders für verschmutze und vermischte Kunststoffreaktionen, zusätzlich aber auch für schadstoffbelastete.
Pyrolyse
Bei der Pyrolyse werden Thermoplasten in ihre Polymere durch Hitzeeinwirkung zerlegt. Dieser Vorgang ist eine Erhitzung, bei der allerdings keinerlei Sauerstoff bzw. Luft hinzugefügt wird. Dies wird durch ein Verfahren namens "Vergasung", bei welchem stark erhitztes Gas in die eine Kammer mit dem Thermoplast gepumpt wird. Dabei werden hohe Temperaturen erzielt, welche nötig sind, da die Thermoplasten nicht nur neugeformt werden sollen, sondern die einzelnen Polymer- Stränge losgelöst werden sollen.
Hydrolyse
Als Hydrolyse bezeichnet man die Spaltung von einer Verbindung, durch eine Reaktion mit Wasser. Die Reaktionsgleichung lautet hierbei: Spaltrest 1 + Wasseratom --> Spaltrest 2 + Hydroxylrest
Recycling-Code
Der Recycling-Code dient der einfachen Identifizierung von chemischen Stoffen. Im Bezug auf Kunststoffe zeigt es auf, welche Stoffe wie recycelt werden können und ob die Kunststoffe potenziell gefährlich sind.
- Kunststoffe der ersten Recycling Klasse PET(E) werden häufig in Trinkflaschen und Folien genutzt. Sie werden zu Dingen wie Fleecejacken und Surfbrettern recycelt.
- Kunststoffe der zweiten Recycling Klasse HDPE werden in Saft-,Milch- und Wasserflaschen genutzt, des Weiteren auch in Tragetaschen und Plastikrohren. Recycelt werden sie zu Dingen wie Picknicktischen.
- Kunststoffe der dritten Recycling Klasse PVC ,oder auch nur V genannt, werden für die Herstellung von Spülmittelflaschen und Kunststoff-Rohren genutzt. Die Recycling Produkte sind meistens Objekte wie Geländer oder Rohre.
- Kunststoffe der vierten Recycling Klasse LDPE werden genutzt, um Plastik-, Obst-, und Brötchentüten herzustellen. In diese können sie dann auch einfach wieder recycelt werden.
- Kunststoffe der fünften Recycling Klasse PP werden für stabile Kunststoffprodukte wie Dachverkleidungen oder Stoßstangen-Puffer gebraucht. Sie sind auch in dingen wie Strohalmen und Senftuben zu finden. Sie sind schwer zu recyclen, können allerdings manchmal für die Herstellung von Autobatterie-Kästen genutzt werden.
- Kunststoffe der sechsten Recycling Klasse PS, auch bekannt als Styropor, werden vornehmlich eingesetzt als Dichtungen und können zu Spielzeug und Koffern recycelt werden.
- Kunststoffe der siebten Recycling Klasse OTHER oder auch nur O werden bei verschiedenen Flaschen wie Ketchup-, Senf- oder Saft-Flaschen genutzt. Sie sind schwer zu recyclen, da sie aus vielen verschiedenen Kunststoff schichten Bestehen, allerdings können manche zu Parkbänken etc. recycelt werden.
Energetische Verwertung
Falls ein Stoff nicht mehr weiter recycelt wird, wird er energetisch verwertet. Der Stoff wird in einer Müllverbrennungsanlage verbrannt und wird zur Strom- und Wärmegewinnung genutzt. Recyclen wird der energetischen Verwertung immer vorgezogen.
Versuche
1. Versuch:
Herstellen von Polystyrol
Intention: Anwendungsbeispiel für eine Polymerisationsreaktion
Geräte: Reagenzglas, Glasstab, Wasserbad, Dreifuß, Bunsenbrenner
Chemikalien: Styrol (mindergiftig), Cumolhydroperoxid (ätzend,brandfördernd)
Durchführung:In ein Reagenzglas geben Sie 10 ml Styrol und vermischen es gut mit 1 ml Cumolhydroperoxid. Das Reagenzglas stellen Sie in ein Becherglas mit siedendem Wasser. Sobald sich die Viskosität verändert entnimmt man das Reagenzglas und lässt es Abkühlen.
Beobachtung: Was verändert sich im Hinblick auf die Viskosität?
- Was für ein Produkt entsteht?
Formulieren Sie die im Versuch zu erkennenden Reaktionsschritte und erklären Sie den Reaktionsmechanismus in den einzelnen Phasen.
2. Versuch
Recycling von Kunststoffen durch Umschmelzen
Intention: Die Bedeutung des Recycling von Kunststoffen darzustellen.
Geräte: Bunsenbrenner, Dreifuß mit Drahtnetz, Metall-Ausstechform für Gebäck, Aluminiumfolie, Schere
Chemikalien: Polyethen, Polypropen (z.B Spülmittelflaschen)
Durchführung: Alte Spülmittelflaschen und deren Verschlüsse bestehen oft aus Polyethen (Flasche) und Polypropen (Verschluss). Diese werden gereinigt und mit einer Schere in kleine Stücke geschnitten. Zwei Ausstechformen werden doppelt mit Aluminiumfolie ausgekleidet. In diese füllt man jeweils Stücke von Polyethen und Polypropen mit einer Schichtdicke von 0,5 cm. Anschließend erhitzt man mit dem Bunsenbrenner.
Quellen
- https://de.wikipedia.org/wiki/Monomer
- Chemie Buch: elemente chemie 2 (Seite 306 ff.)
- https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/polyvinylchlorid-pvc
- https://www.chemie.de/lexikon/Polyethylen.html
- https://www.plasticseurope.org/de/focus-areas/circular-economy/zero-plastics-landfill/recycling-and-energy-recovery
- https://www.kunststoffe.de/themen/basics/technische-kunststoffe/polyamide-pa/artikel/polyamide-pa-651963
- https://www.internetchemie.info/chemie-lexikon/funktionelle-gruppen/p/peptid-bindung.php
- https://www.alba.info/unternehmen/service/glossar/energetische-verwertung.html
- http://www.all-recycling.de/hausmuell-recyceln/plastik-recycling-code.html
- http://chemie-digital.zum.de/wiki/Frau_Lachner/Oberstufe_neu/Grundlagen_der_Polymer-Chemie
- http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/12/oc/vlu_organik/radikale/radikale_einfuehrung.vlu/Page/vsc/de/ch/12/oc/radikale/radikalreaktionen/radikalreaktionen.vscml.html
- http://www.chemieunterricht.de/dc2/auto/a-v-kst9.htm
- http://www.chemieunterricht.de/dc2/haus/v126.htm
- https://www.youtube.com/user/TheSimpleChemics