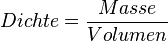Was die Siedetemperatur von Molekülen beeinflusst: Unterschied zwischen den Versionen
| Zeile 1: | Zeile 1: | ||
| + | == Polarität == | ||
| − | + | ||
| − | + | == Wasserstoffbrückenbindung == | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | == Van der Waals-Kräfte == | |
| + | |||
| + | === Oberflächenspannung === | ||
| + | |||
| + | |||
| + | |||
| + | === Dichteanomalie des Wassers === | ||
| + | |||
| + | Wasser zeigt eine Besonderheit, wenn man die Dichte bei verschiedenen Temperaturen betrachtet. Eine Besonderheit, die es bei keinem anderen Stoff in der Art gibt. Üblicherweise ist es so, dass sich die Dichte eines Stoffes bei sinkender Temperatur erhöht. Grund dafür ist, dass die Teilchen bei sinkenden Temperaturen immer langsamer werden und dadurch näher zusammenrücken können. Da sich dabei das Volumen verringert, wird die Dichte größer, denn die Dichte wird ja berechnet durch | ||
| + | * <math>Dichte = \frac{Masse}{Volumen}</math> | ||
| + | |||
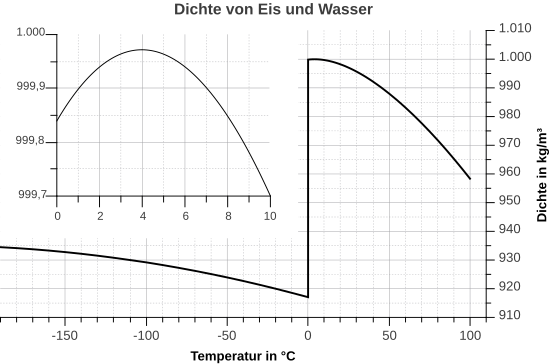
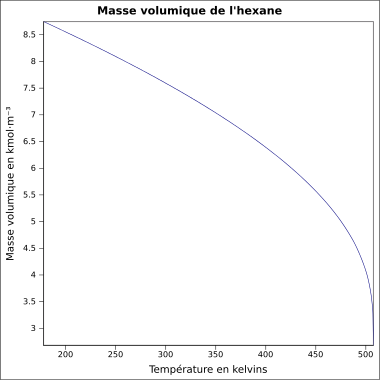
| + | Bei Wasser ist das nicht so. Es hat seine höchste Dichte bei 4°C. Dagegen ist die Dichte bei festem Wasser, also Eis, sehr viel geringer. Hexan verhält sich "normal". Man erkennt, dass die Dichte sich mit der Temperatur kontinuierlich verändert: Je wärmer, desto kleiner wird die Dichte, denn bei einer schnelleren Bewegung brauchen die Teilchen mehr Platz, das Volumen vergrößert sich und so wird der Bruch kleiner. | ||
| + | |||
| + | <center>[[File:Density_of_ice_and_water_%28de%29.svg|550px]] [[File:Masse volumique hexane.svg|380px]]</center> | ||
| + | |||
| + | Im Film zeigt sich dies deutlicher. Man vergleicht das Verhalten von Wasser, mit Wachs und Eisessig (99%iger Essig). | ||
| + | |||
| + | <center>{{#ev:youtube|OfzbHz1e12E}}</center> | ||
Version vom 13. März 2013, 21:19 Uhr
Inhaltsverzeichnis |
Polarität
Wasserstoffbrückenbindung
Van der Waals-Kräfte
Oberflächenspannung
Dichteanomalie des Wassers
Wasser zeigt eine Besonderheit, wenn man die Dichte bei verschiedenen Temperaturen betrachtet. Eine Besonderheit, die es bei keinem anderen Stoff in der Art gibt. Üblicherweise ist es so, dass sich die Dichte eines Stoffes bei sinkender Temperatur erhöht. Grund dafür ist, dass die Teilchen bei sinkenden Temperaturen immer langsamer werden und dadurch näher zusammenrücken können. Da sich dabei das Volumen verringert, wird die Dichte größer, denn die Dichte wird ja berechnet durch
Bei Wasser ist das nicht so. Es hat seine höchste Dichte bei 4°C. Dagegen ist die Dichte bei festem Wasser, also Eis, sehr viel geringer. Hexan verhält sich "normal". Man erkennt, dass die Dichte sich mit der Temperatur kontinuierlich verändert: Je wärmer, desto kleiner wird die Dichte, denn bei einer schnelleren Bewegung brauchen die Teilchen mehr Platz, das Volumen vergrößert sich und so wird der Bruch kleiner.
Im Film zeigt sich dies deutlicher. Man vergleicht das Verhalten von Wasser, mit Wachs und Eisessig (99%iger Essig).