Polymerisation: Unterschied zwischen den Versionen
Emjale (Diskussion | Beiträge) (→2. Phase: Erzeugung von Monomer-Radikalen) |
|||
| Zeile 1: | Zeile 1: | ||
| − | === Polymerisation === | + | [[Radikale ]]=== Polymerisation === |
Die Polymerisation ist ein Vorgang, bei dem ein Kunststoff gebildet wird. Es handelt sich dabei um eine Reaktionsfolge, die immer in gleichen Schritten abläuft und sich wiederholt. Man unterscheidet dabei die '''ionische Polymerisation''' und die '''radikalische Polymerisation'''. | Die Polymerisation ist ein Vorgang, bei dem ein Kunststoff gebildet wird. Es handelt sich dabei um eine Reaktionsfolge, die immer in gleichen Schritten abläuft und sich wiederholt. Man unterscheidet dabei die '''ionische Polymerisation''' und die '''radikalische Polymerisation'''. | ||
| Zeile 42: | Zeile 42: | ||
== radikale Polymerisation == | == radikale Polymerisation == | ||
| − | Bei der radikalischen Polymerisation werden Radikale, welche ein freies, ungepaartes Elektron besitzen, als Initiator verwendet, also als Molekül, dass die Reaktion anstößt.. Diese spalten die Doppelbindungen von [[Monomere|Monomeren]] auf, welche dann zu [[Polymer|Polymeren]] reagieren. Diese Reaktion läuft in 4 Phasen ab. | + | Bei der radikalischen Polymerisation werden [[Radikale|Radikale ]], welche ein freies, ungepaartes Elektron besitzen, als Initiator verwendet, also als Molekül, dass die Reaktion anstößt.. Diese spalten die Doppelbindungen von [[Monomere|Monomeren]] auf, welche dann zu [[Polymer|Polymeren]] reagieren. Diese Reaktion läuft in 4 Phasen ab. |
====1. Phase: Bildung Startradikale ==== | ====1. Phase: Bildung Startradikale ==== | ||
Version vom 8. November 2018, 22:44 Uhr
Radikale === Polymerisation ===
Die Polymerisation ist ein Vorgang, bei dem ein Kunststoff gebildet wird. Es handelt sich dabei um eine Reaktionsfolge, die immer in gleichen Schritten abläuft und sich wiederholt. Man unterscheidet dabei die ionische Polymerisation und die radikalische Polymerisation.
Inhaltsverzeichnis |
ionische Polymerisation
Bei der ionischen Polymerisation handelt es sich um eine Polymerisation die durch Ionen stattfindet. Man unterscheidet zwischen zwei verschiedenen Arten, einmal der kationischen Polymerisation, die durch Kationen stattfindet und der anionischen Polymerisation, die durch Anionen stattfindet. Beide Arten durchlaufen drei verschiedene Phasen, den Kettenstart, den Kettenwachstum und den Kettenabbruch, wobei jedoch bei der anionischen Polymerisation zu dem Fall kommen kann, dass keine Abbruchreaktion formuliert werden könnte.
Kationische Polymerisation
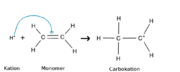
Um eine kationische Polymerisation durchführen zu können, benötigt man ein Kation, also ein positiv geladenes Teilchen, welches dann mit einem Monomer reagieren kann. Im Folgendem wird der Mechanismus am Beispiel von Polyethylen (PE) erklärt.
1) Kettenstart
Zu Beginn liegt ein Wasserstoff-Ion, das Kation, vor. Dieses reagiert mit Ethen, dem Monomer. Es löst die Doppelbindung der C-Atome innerhalb des Ethens auf und bindet sich an ein Kohlenstoffatom. Nun hängt das Wasserstoff-Ion am Monomer. Die positive Ladung ist verschoben worden und sitzt jetzt am Ende des früheren Ethens.
2) Kettenwachstum
Das entstandene Carbokation reagiert nun weiter nach dem Prinzip des Kettenstarts. Das Kation des Carbokations löst erneut die Doppelbindung eines neuen Ethens, bindet sich an diese und hängt am Monomer. Dieser Vorgang wird nun weiter wiederholt.
3) Kettenabbruch
Um die Reaktion abzubrechen muss ein Anion, ein negativ geladenes Teilchen, an der Reaktion teilnehmen. Dadurch, dass das Anion mit dem Kation reagiert, existiert kein freies Kation mehr, das mit einem weiteren Monomeren reagieren könnte. Somit kann die Kette nicht mehr wachsen und Polyethylen (PE) (in Plastiktüten und Mülltonnen vorhanden) ist entstanden.
Anionische Polymerisation
Die anionische Polymerisation läuft grundsätzlich wie die der kationischen ab. Der grundlegende Unterschied liegt darin, dass die Reaktion mit einem Anion, einem negativ geladenem Teilchen, gestartet wird.
1) Kettenstart
Das Anion, welches Zu Beginn liegt ein Wasserstoff-Ion, das Kation, vor. Dieses reagiert mit Ethen, dem Monomer. Es löst die Doppelbindung der C-Atome innerhalb des Ethens auf und bindet sich an ein Kohlenstoffatom. Nun hängt das Wasserstoff-Ion am Monomer. Die positive Ladung ist verschoben worden und sitzt jetzt am Ende des früheren Ethens.
2) Kettenwachstum
3) Kettenabbruch
Ein Kettenabbruch findet nur dann statt, wenn ein Proton hinzugegeben wird. Falls nicht
radikale Polymerisation
Bei der radikalischen Polymerisation werden Radikale , welche ein freies, ungepaartes Elektron besitzen, als Initiator verwendet, also als Molekül, dass die Reaktion anstößt.. Diese spalten die Doppelbindungen von Monomeren auf, welche dann zu Polymeren reagieren. Diese Reaktion läuft in 4 Phasen ab.
1. Phase: Bildung Startradikale
Hierbei werden Verbindungen homolytisch aufgespalten. Das bedeutet, dass die Elektronen sich gleichmäßig verteilen, eines zur einen Seite und eines zur anderen. Diese Spaltung erfolgt durch Licht und Wärme.
2. Phase: Erzeugung von Monomer-Radikalen
Bei der Erzeugung eines Monomer-Radikals verbindet sich das freie Elektron des Startradikale mit einem Elektron der Doppelbindung des Kohlenstoffmoleküls. Somit kann es eine einfache Elektronenbindung zum C- Atom eingehen. Das andere Elektron der Doppelbindung ist nun ein freies, ungeplantes Elektron am C- Atom. Gebildet wird also ein Monomer- Radikal, welches aus dem Startradikal, dem Kohlenstoffatom und dem freien, ungepaarten Elektron besteht. Bei der Beispielgleichung handelt es sich um eine Strukturgleichung die mit einem x gekennzeichnet ist, welches durch verschiedene Stoffe ersetzbar ist, um einen bestimmten Werkstoff herzustellen. Benutzt man also Cl an stelle des X, erhält man am Ende der Phasen Polyvinylchlorid (PVC).
3. Phase: Kettenwachstum
In der Phase des Kettenwachstums geht es darum, die Kette von Monomeren zu verlängern. Hierbei geht das freie Elektron des Monomer-Radikals eine einfache Elektronenbindung mit dem c-Atom durch Aufspaltung der Doppelbindung eines weiteren Monomers ein. Die Doppelbindung spaltet sich homolytisch, ein Elektron wird benötigt um eine einfache Elektronenbindung von Monomer-Radikal und weiterem Monomehr herzustellen. Bei dem übrigen Elektron handelt es sich wieder um ein freies, ungepaartes, dass bereit ist, eine weitere Bindung mit einem zweiten Monomer einzugehen. Insgesamt entsteht dabei ein längeres Radikal, dass man als Produktradikal bezeichnet. Diesen Vorgang kann man beliebig oft fortsetzen. Da das Dokumentieren jedoch sehr unübersichtlich wäre setzt man eine Klammer um das Monomer in der Kette und schreibt unten rechts die Anzahl verwendeter weitere Monomere hin. Bildet man also eine Kette mit 10 weitern Monomeren, wäre die Zahl unten rechts 10.
4. Phase: Kettenabbruch
Um die Bildung einer längeren Kette zu stoppen, kann man das Radikal mit einem weiteren Radikal reagieren lassen. Dabei entsteht zwischen den Radikalen, die jeweils ein freies Elektron haben, eine einfache Elektronenbindung. Jedoch gibt es nun kein freies Elektron mehr, dass in der Lage wäre, die Doppelbindung eines weiteren Monomers aufzuspalten. Somit kann keine Elektronenbindung entstehen und die Kette kann sich nicht weiter fortsetzen. Dies funktioniert sowohl mit dem Startradikal, als auch mit dem Monomer-Radikal und dem Produktradikal.