Die Elemente in der Antike
Chemie, chemische Reaktionen und das Herstellen von neuen Stoff ist für euch schon so selbstverständlich, dass es schwer nachvollziehbar ist, welche Leistungen die ersten Chemiker bzw. Alchemisten vollbracht haben. Daher zunächst einmal ein kleiner Einblick in die Zeit, als Chemie erst dabei war eine Naturwissenschaft zu werden.
Inhaltsverzeichnis |
Einstieg: Von der Philosophie zur Alchemie
Mehr als ein Jahrtausend hindurch meinten die Philosophen, die Erde bestünde aus vier Elementen: dem trockenen und warmen Feuer, der warmen und feuchten Erde, dem feuchten und kalten Wasser und der kalten und trockenen Luft. Es wurden außerdem Symbole verwendet, mit denen die Elemente dargestellt wurden. Viele Jahrhunderte gab es keine Diskussionen über diese Vorstellung. Die Chemie in der Antike bestand im angesammelten praktischen Wissen über Stoffumwandlungsprozesse und den naturphilosophischen Anschauungen der Antike.Erst im frühen Mittelalter entwickelten die ![]() Alchemisten eine Art nur von ihnen zu lesende Geheimsprache und Geheimschrift. Die von damals bekannten Symbole zeigen auch, welche Elemente damals schon bekannt waren.
Alchemisten eine Art nur von ihnen zu lesende Geheimsprache und Geheimschrift. Die von damals bekannten Symbole zeigen auch, welche Elemente damals schon bekannt waren.
Man geht davon aus, dass vor dem 18. Jahrhundert nur die folgenden 15 Elemente bekannt waren:
- Metalle
- wie Eisen, Kupfer, Blei, Bismut, Arsen, Zink, Zinn, Antimon, Platin, Silber, Quecksilber und Gold
- Nichtmetalle
- wie Kohlenstoff, Schwefel und Phosphor.
Bis zum Ende des 16. Jahrhunderts basierte die Vorstellungswelt der Alchemisten in der Regel nicht auf wissenschaftlichen Untersuchungen, sondern auf Erfahrungstatsachen und empirischen Rezepten. Alchemisten führten eine große Auswahl Experimente mit vielen Substanzen durch, um ihre Ziele zu erreichen. Sie notierten ihre Entdeckungen und verwendeten für ihre Aufzeichnungen die gleichen Symbole, wie sie auch in der Astrologie üblich waren. Die mysteriöse Art ihrer Tätigkeit und die dabei oftmals fabrizierten farbigen Flammen, Rauch oder Explosionen führten dazu, dass sie als Magier und Hexer bekannt und teilweise verfolgt wurden. Für ihre Experimente entwickelten die Alchemisten die gleichen Apparaturen, wie sie heute noch in der chemischen Verfahrenstechnik verwendet werden. Die Chemie in der Neuzeit erhielt als Wissenschaft entscheidende Impulse im 18. und 19. Jahrhundert: Sie wurde auf die Basis von Messvorgängen und Experimenten gestellt – den Gebrauch der Waage sowie die Beweisbarkeit von Hypothesen und Theorien über Stoffe und Stoffumwandlungen.
Die meisten Elemente wurden im 19. Jahrhundert entdeckt und wissenschaftlich beschrieben. Zu Beginn des 20. Jahrhunderts waren nur noch zehn der natürlichen Elemente unbekannt. Seither wurden vor allem schwer zugängliche, oftmals radioaktive Elemente dargestellt. Viele dieser Elemente kommen nicht in der Natur vor und sind das Produkt von künstlichen Kernverschmelzungsprozessen.
Frage: Warum waren nur so wenig Elemente bekannt?
Die Frage lässt sich leicht klären:
Da die Alchemisten die Begriffe Verbindungen und Elemente nicht kannten, wurde alles als Stoff betrachtet. Chemische Reaktionen und Synthesen oder wurden nicht systematisch durchgeführt, sondern waren Folge von "Herumexperimentieren". Man konnte einfach nicht zwischen Verbindungen und Elementen unterscheiden und so fand auch keine gezielte Suche nach Elemente statt.
|
Schaut euch einen Ausschnitt aus dem Film Faszination Chemie (Teil 1 von 3) an, der sich mit den Anfängen der Chemie beschäftigt. Es wird u.a. gezeigt, wie der Chemiker Henning Brand versuchte, aus Urin Gold zu gewinnen. Das Bild rechts oben soll Brand bei seiner Entdeckung zeigen. |
Beispiele für Elemente, die seit der Antike bekannte sind
Bis auf das Phosphor sind alle im Mittelalter bekannten Elemente in der Natur rein vorkommend, gediegen. Dazu ein paar Bilder aus Wikipedia, die einige der damals bekannten Elemente in ihrem natürlichen Vorkommen zeigen. Ergänzende Bild-Beschriftungen bekommt ihr, wenn ihr den Mauszeiger über das Bild haltet:
| Schwefel kommt natürlich in Form von Kristallen vor, kann aber auch in der Nähe von Vulkanen gefunden werden. Es gibt riesige unterirdische Ansammlungen, die in großem Umfang abgebaut werden. Weitere Bilder gibt es im Wikipedia-Artikel zu Bilder zum Abbau an Vulkanen: [1][2] und Schema zur industrielle Gewinnung von unterirdischen Schwefel-Lagerstätten. [3] |
  |
  |
Kohlenstoff tritt natürlich in zwei unterschiedlichen Formen (sogenannte Modifikationen) auf, obwohl beide nur aus Kohlenstoff-Atomen bestehen. Als Diamant und als Graphit. Sie unterscheiden sich nur in der Anordnung und der Verknüpfung der einzelnen Atome. |
| Kupfer, das in der Natur relativ selten gediegen vorkommt, ist als Mineral anerkannt. Es kommt gediegen entweder in Form von „kupferroten“, metallisch glänzenden Nuggets (aus der Schmelze erstarrt) oder in verzweigten Strukturen, so genannten Dendriten, vor. |   |
 |
Quecksilber kommt in reiner Form in der Natur vor und ist als einzige flüssige Substanz aus Tradition als Mineral anerkannt. Meist findet man es als Mineral in Form von Zinnober (HgS) in Gebieten mit ehemaliger vulkanischer Aktivität. Seltener kommt Quecksilber auch gediegen vor. |
| Im Gegensatz zu den meisten anderen Metallen kommt Gold meist gediegen vor. Direkt sichtbares Gold, sogenanntes „Freigold“ in Form von Nuggets oder Goldstaub ist eine Rarität. Das meiste Gold in den Vorkommen liegt in kleinsten Partikelchen im umgebenden Gestein fein verteilt vor und entgeht somit den Versuchen, es mit einfachen Verfahren zu sammeln. |  |
 |
Das meiste Silber wird aber aus Silbererzen gewonnen, die oft zusammen mit Blei-, Kupfer- und Zinkerzen als Sulfide oder Oxide vorkommen. Gediegen kommt es in vielfältiger Form vor: als Blech, Dräht, Körner, Locken, Kristalle und dendritisch als Bäumchen bzw.`Fischgrätensilber` |
| Arsen kommt praktisch überall im Boden in geringen Konzentrationen von bis zu 10 ppm vor. Als sogenannter Scherbenkobald kommt es in der Natur auch gediegen vor. |  |
Zusammenfassung einiger geschichtlicher Daten zu den Elementen
- Von den Elementen im heutigen Sinne waren in der Antike nur wenige in Reinform bekannt, die entweder gediegen vorkamen oder aus Erz geschmolzen werden konnten: Kohlenstoff, Schwefel, Eisen, Kupfer, Zink, Silber, Zinn, Gold, Quecksilber und Blei. Im Laufe der mittelalterlichen Bergbaugeschichte wurden dann, vor allem im Erzgebirge, in Erzen geringe Mengen an Beimengungen unbekannter Metalle entdeckt und nach Berggeistern benannt (Cobalt, Nickel, Wolfram)
- 1661 definierte
 Robert Boyle ein chemisches Element als einen Reinstoff, der mit chemischen Methoden nicht weiter zerlegt werden kann und verwendete somit den Begriff ganz anders als zuvor die Vier-Elemente-Lehre (Feuer, Wasser, Luft und Erde).
Robert Boyle ein chemisches Element als einen Reinstoff, der mit chemischen Methoden nicht weiter zerlegt werden kann und verwendete somit den Begriff ganz anders als zuvor die Vier-Elemente-Lehre (Feuer, Wasser, Luft und Erde).
- 1669 läutet die Entdeckung des Phosphors durch
 Hennig Brand schließlich das Zeitalter der Entdeckung der meisten Elemente ein.
Hennig Brand schließlich das Zeitalter der Entdeckung der meisten Elemente ein.
- 1807 nutze
 Davy Humphry Davy als erster elektrischen Strom, den er aus einer
Davy Humphry Davy als erster elektrischen Strom, den er aus einer  Voltaschen Säule gewann, um Natrium und Kalium als neue chemische Elemente gewinnen.
Voltaschen Säule gewann, um Natrium und Kalium als neue chemische Elemente gewinnen.
- 1940 wurden die ersten echten künstliche Elemente hergestellt, das Neptunium und das Plutonium.
Frage: Woher haben die Elemente ihre Namen?
Eine sehr ausführliche Auflistung, woher die Elemente ihre Namen haben, findet ihr auf der Wikipedia-Seite ![]() Etymologische Liste der chemischen Elemente .
Etymologische Liste der chemischen Elemente .
Zusammengefasst:
Viele Elementnamen leiten sich von Eigenschaften ab. Vor allem bei den Namen der alten Elemente ist das der Fall:
- Gold (von indogermanisch ghel: glänzend, (gelb))
- Quecksilber bedeutet ursprünglich „lebendiges Silber“ (althochdeutsch quecsilbar zu germanisch kwikw = lebendig)
- Helium (vom altgriechischen Wort ἥλιος (hélios) = Sonne) wurde aufgrund seiner Spektrallinien im Licht der Sonne nachgewiesen.
- Radium (von lat. radius = Strahl), wegen seiner Radioaktivität
Der Herkunftsort, wo ein Element zuerst gefunden, wird auch häufig genutzt:
- Ytterbium und Yttrium haben ihren Namen von Ytterby, einer Grube auf einer Schäreninsel nördlich von Stockholm.
Oder ein Mineral aus dem das Element zuerst gewonnen wurde:
- Beryllium vom Beryll, einem Edelstein, der Beryllium enthält.
Manchmal wird ein Element auch nach dem Finder genannt:
- Gadolinium wurde nach dem Entdecker des Minerals Gadolinit, dem finnischen Chemiker Johan Gadolin, benannt.
Zuletzt werden Elemente vor allem ehrenhalber benannt, zum Beispiel nach Personen oder Orten und Ländern. Dabei haben die Finder der Elemente die Möglichkeit zu wählen und verwenden deshalb meisten Namen, die aus ihrem Land stammen.
- Galium ist benannt nach Gallien, dem lateinischen Namen für Frankreich.
- Germanium (von lat. Germania „Deutschland“, dem Vaterland des Entdeckers Clemens Winkler
- Hassium leitet sich vom lateinischen Namen Hassia für das Bundesland Hessen ab.
- Curium wurde nach den Forschern Marie Curie und Pierre Curie benannt.
- Einsteinium wurde zu Ehren Albert Einsteins benannt.
Wenn du die Seite durchgelesen hast, solltest du einen kleinen Eindruck bekommen haben, wie es in der Chemie früher war. Um dich zu testen, bearbeite bitte den Multiple-Choice-Test hier durch.
Frage: Woher hat die Bronze-Zeit ihren Namen?
Das Besondere an der Bronze-Zeit ist, dass es der Menschheit in diesem Zeitalter gelang, in immer größeren Mengen Bronze herzustellen, eine Legierung (also Gemisch) von Kupfer und anderen Metallen. Kupfer war zwar schon bekannt, da es auch gediegen vorkam, aber nur in geringen Mengen. Bei Funden aus der Bronzezeit fand man aber immer mehr Gegenstände und Waffen aus Bronze, die einen erheblichen Vorteil gegenüber Hilfsmitteln aus Stein und Holz hatte.
Die Entdeckung, dass man Kupfer auch herstellen kann, ist daher eine erstaunliche Leistung. Sie wird im Film Terra X - Die Minen des Hephaistos sehr ausführlich erklärt und gezeigt. Wer Zeit hat, kann sich den 60 min. langen Film (in 6 Teilen) auf YouTube ![]() anschauen.
anschauen.
|
Nach dem Anschauen, des kleines Filmes, wird das das Arbeitsblatt bearbeitet, das in der Schule ausgegeben wurde, zum Thema "Ötzi und das Kupferbeil". Es soll anhand der chemischen Reaktion erklärt werden, warum die Gewinnung des Kupfers so möglich ist. 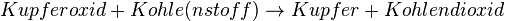
Man kann die Gesamtreaktion in zwei Teilreaktionen zerlegen. Die Reaktion von Kohle (mit Sauerstoff) zu Kohlendioxid, die exotherm ist, und die Reaktion von Kupferoxid zu Kupfer (unter Sauerstoff-Abgabe), die endotherm ist. Die "Oxidation" der Kohle liefert genügend Energie, um die "Reduktion" des Kupferoxids zu ermöglichen. Gleichzeitig verhindert die Kohle, dass das Kupfer wieder mit dem Sauerstoff reagiert, indem es den Sauerstoff "wegnimmt". |
|
|
Bearbeitet die zwei Multiple-Choice-Tests zu den dort gezeigten Videos, um das Erlernte bei zwei weiteren Reaktionen anzuwenden. Jeder hält dann für sich die zwei Reaktionsgleichungen mit Überschrift im Heft fest. Bei jeder Reaktion sollen Reduktion und Oxidation mit Hilfe von zwei zusätzlichen Pfeilen eingezeichnet werden, die zwei Teilreaktionen getrennt aufgeschrieben werden und welche der Teilreaktion exotherm bzw. endotherm ist. Zeichnet auch ein Energiediagramm für die beiden Teilreaktionen und formuliert abschließend zu jeder Reaktion zwei Sätze, warum diese Redoxreaktion abläuft. |
Damit du testen kannst, ob du so einigermaßen verstanden hast, wie solche Redoxreaktionen funktionieren, gibt es zur Kontrolle einen Lückentext und speziell zu den Energiediagrammen zwei zusätzliche Tests auf einer Seite. Falls Ihr mit der Aufgabe 3 schon schneller fertig seid als die anderen könnt ihr das noch im Unterricht machen, ansonsten machst du es alleine zu Hause.


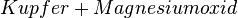 ↛
↛