Warum man manche Feuer nicht mit Wasser löschen kann
Betrachten wir ein Beispiel, damit das Problem genau erkennen können:
| Bengalisches Feuer (bengalisches Licht, bengalische Flamme oder kurz Bengalo) ist ein Effekt der Pyrotechnik unter Benutzung eines weißen oder farbigen pyrotechnischen Satzes. Bengalische Feuer werden zur effektvollen Beleuchtung eingesetzt, zum Beispiel von Büsten, Statuen, Gebäuden und Gärten. Die Flammenfärbung ist abhängig von dem verwendeten Metall, das dem Brennstoff zugemengt ist. Charakteristisch für Bengalos sind ein greller Lichtschein und eine intensive Rauchentwicklung (wobei es auch möglich ist, Flammen mit wenig Rauchentwicklung zu erzeugen).
|
Im Wikipedia-Artikel werden einige Gefahren erwähnt:
... Ein Löschen dieser pyrotechnischen Feuer ist mit Sand nur bedingt, mit Wasser jedoch gar nicht möglich.
|
Experiment: Wasserdampf löscht nicht alles
| VERSUCH:
Lehrerexperiment In einem Erlenmeyer-Kolben mit weiter Öffnung wird Wasser über einem Bunsenbrenner zum Kochen gebracht. In den entweichenden Wasserdampf werden verschiedene brennende Dinge gehalten:
|
- Beobachtung: Der brennende Holzstab und die glühende Eisenwolle gehen sofort aus. Das Magnesium wird jedoch nicht gelöscht. Man kann sogar erkennen, dass an der Öffnung des Erlenmeyer-Kolbens eine weitere Flamme zu sehen ist. Schaut euch das Experiment noch einmal hier an.
Eigentlich wäre ja zu erwarten, dass das Magneisum nicht weiterbrennen kann, denn der Wasserdampf verdrängt die normale Luft und damit auch den darin enthaltenen Sauerstoff, der gebraucht wird, um das Verbrennen des Magnesium weiter zu unterstützen. Beim Holzstäbchen oder bei der Eisenwolle scheint es zu funktionieren und beide werden gelöscht.
Brennt das Magnesium also weiter, so muss es woanders her den Sauerstoff bekommen. Und da kommt nur das Wasser infrage, von dem wir ja wissen, dass es eine Verbindung aus Wasserstoff und Sauerstoff ist.
Damit findet also folgende Reaktion beim Magnesium statt:
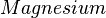
|
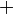
|
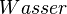
|
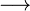
|
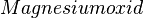
|
|
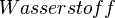
|
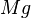
|
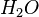
|
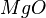
|
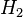 |
- Beschreibung: Wenn man das Magnesium anzündet hat man natürlich erst einmal eine Reaktion von Magnesium mit dem Sauerstoff aus der Luft. Im Erlenmeyerkolben, der mit Wasserdampf gefüllt ist, fehlt dieser "freie" Sauerstoff und so muss das Magnesium auf den gebundenen Sauerstoff im Wassermolekül zugreifen. Das wird deutlich, wenn man die Symbolschreibweise für die beteiligten Stoffe kennt. Und nimmt man vom Wasser (H2O) den Sauerstoff (O) weg, so bleibt der Wasserstoff (H) übrig. Und dieser Wasserstoff ist es übrigens, den man an der Öffnung des Erlenmeyerkolbens mit gelber Flamme verbrennen sieht.
Fragen:
- Sauerstoff im Wasser gelöst?


