Die Sammlung der folgenden Aufgaben ist sehr ausführlich und es werden teilweise Aufgaben gestellt, die für bessere Schüler langweilig erscheinen. Wenn du weißt, dass du nicht so stark bist, bearbeite alle Aufgaben nacheinander. Nur wenn du dir sicher bist, dass du eine Aufgabe kannst, solltest du sie überspringen. Teilweise kann man ja die ersten Aufgaben schon bearbeiten und die dann kontrollieren. Wenn alles richtig ist, überspringe die Aufgaben, die dir zu leicht erscheinen.
Hier nun noch mal die wichtigen Begriffe ...
Zur Erinnerung:
- Oxidation = Sauerstoffaufnahme oder Elektronenabgabe
- Reduktion = Sauerstoffabgabe oder Elektronenaufnahme
- Reduktionsmittel = Stoff, der beim Reaktionspartner die Reduktion bewirkt, indem er ihm Elektronen abgibt
- Oxidationsmittel = Stoff, der beim Reaktionspartner die Oxidation bewirkt, indem er ihm Elektronen abnimmt
|
Unter einem Redoxpaar versteht man ein Paar von Teilchen, die durch Auf- bzw. Abnahme ineinander überführt werden können.Zum Beispiel:
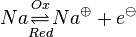 und und 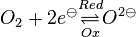
|
 Aufgabe 3a - Verstehst du die Begriffe zu den Redoxreaktionen?
|
 Aufgabe 3b - Welche Art von Reaktion haben wir hier?
|
Eine Grundlegende Aufgabe ist die Bestimmung der Ladung von Ionen der Hauptgruppenelemente. Weil diese Aufgabe so grundlegend ist, wird sie für einige etwas einfach sein, aber Übung schadet trotzdem ist, oder? Das PSE ist hier ein wichtiges Hilfsmittel!
Folgende Regeln sollte man beachten:
- Die Atome der Hauptgruppen-Elemente versuchen den Edelgaszustand (meist 8 Außenelektronen) zu erreichen, indem sie Elektronen aufnehmen oder abgeben. Z.B.Na erreicht Ne-Elektronenkonfiguration und P erreicht Elektronenkonfiguration von Ar. Die Ausnahme ist das Helium mit zwei Außenelektronen
- Da der Edelgaszustand immer durch Abgabe oder Aufnahme erreicht werden kann, wird es meist so sein, das so wenig wie möglich Elektronen aufgenommen oder abgegeben werden. Also
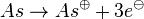 statt statt 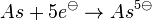 . .
- Die Gesamtanzahl an aufgenommenen oder abgegebenen Elektronen soll so klein wie möglich sein, wenn man eine Ionen-Verbindung betrachtet.
- In Ionenverbindungen haben Metalle meist eine positive Ladung, die Nichtmetalle haben meist eine negative Ladung und die
 Halbmetalle haben je nach Partner eine positive oder negative Ladung. Diese Regel kann aber nicht für Moleküle verwendet werden, dabei wird die Oxidationszahl mit eigenen Regeln bestimmt! Halbmetalle haben je nach Partner eine positive oder negative Ladung. Diese Regel kann aber nicht für Moleküle verwendet werden, dabei wird die Oxidationszahl mit eigenen Regeln bestimmt!
|
 Aufgabe 3c - Element und Ion: Wieviele Elektronen wurden aufgenommen bzw. abgegeben?
|
 Aufgabe 3d
Beliebige Redoxpaare: Wieviele Elektronen wurden aufgenommen bzw. abgegeben?
|
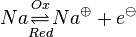 und
und 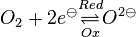
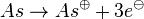 statt
statt 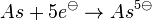 .
.

