Doppelbindung beim Ethen: Unterschied zwischen den Versionen
(→Kontrollfragen zum Verständnis) |
|||
| Zeile 3: | Zeile 3: | ||
| − | {| | + | {| border=0 |
|- | |- | ||
| | | | ||
| Zeile 88: | Zeile 88: | ||
</jmol> | </jmol> | ||
|} | |} | ||
| + | |||
| + | |||
| + | |||
| + | == Kleines Zuordnungsspiel zu den verschiedenen Orbitalen == | ||
| + | Als Eintieg, um sich alles gut merken zu können, eine Wiederholung, was in der interaktiven Darstellung alles zu sehen war. | ||
| + | |||
| + | '''Folgende Bilder von Orbitalen werden gezeigt:''' s-Orbital, p-Orbital, sp<sup>3</sup>-Hybridisierung, sp<sup>2</sup>-Hybridisierung, σ-Bindung, π-Bindung, Doppelbindung. | ||
| + | |||
| + | <div class="memo-quiz"> | ||
| + | {| | ||
| + | |- | ||
| + | | [[File:OrbitalMemoSpiel1.png|100px]] || p-Orbital | ||
| + | |- | ||
| + | | [[File:OrbitalMemoSpiel2.png|100px]] || sp<sup>2</sup>-Hybridisierung | ||
| + | |- | ||
| + | | [[File:OrbitalMemoSpiel3.png|100px]] || s-Orbital | ||
| + | |- | ||
| + | | [[File:OrbitalMemoSpiel4.png|100px]] || σ-Bindung | ||
| + | |- | ||
| + | | [[File:OrbitalMemoSpiel5.png|100px]] || π-Bindung | ||
| + | |- | ||
| + | | [[File:OrbitalMemoSpiel6.png|100px]] || sp<sup>3</sup>-Hybridisierung | ||
| + | |- | ||
| + | | [[File:OrbitalMemoSpiel7.png|100px]] || Doppelbindung | ||
| + | |} | ||
| + | </div> | ||
== Kontrollfragen zum Verständnis == | == Kontrollfragen zum Verständnis == | ||
| Zeile 112: | Zeile 138: | ||
</div> | </div> | ||
| − | == | + | == Halte die folgenden wichtigen Informationen fest == |
| − | + | === Beschriftung sp<sup>3</sup>-Hybridisierung === | |
| + | {{Aufgabe|Skizziere oder drucke dir die Zeichnung rechts aus und beschrifte entsprechend des folgenden Lückentextes.}} | ||
| + | |||
| + | === Beschriftung Doppelbindung === | ||
| + | {{Aufgabe|[[Datei:OrbitalMemoSpiel7.png|100px|rechts]]Skizziere oder drucke dir die Zeichnung rechts aus und beschrifte entsprechend des folgenden Lückentextes. | ||
| + | <div class="lueckentext-quiz"> | ||
| + | |||
| + | Eine Doppelbindung wird aus zwei, sich überlappenden, '''Orbitalen''' gebildet. Wie bei jeder Einfachbindung enthält eine Doppelbindung dabei zunächst einmal eine Sigma-Bindung, die durch Überlappung von '''Hybrid-Orbitalen''' und s-Orbitalen gebildet wird. Dazu kommt beim Ethen ein Pi-Bindung, die dadurch zusammenstande kommt, dass die beiden p-Orbitale der C-Atome sich oberhalb und unterhalb des Sigma-Bindung überlappen. Damit die C-Atome nicht hybridisierte p-Orbitale haben, müssen sie beim Ethen eine sp2-Hybridisierungbridisierung haben. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
| + | |||
| + | |||
| + | }} | ||
| + | |||
| + | |||
| + | === Merktext === | ||
Version vom 4. Mai 2015, 18:54 Uhr
Hinweis zur Bedienung: Das Molekül lässt sich mit der Maus (linke Maustaste) drehen. Mit dem Mausrad kann man hinein und hinaus scrollen.
|
|
Darstellung und Sonstiges:
Hinweis: Leider werden bei einem Atom immer alle Orbitale gelöscht, d.h. wenn man ein Orbital löscht werden alle gelöscht. Betrachtung der Orbitale bei einem Kohlenstoff-Atom und dem damit verbundenen H-Atom:
|
Inhaltsverzeichnis |
Kleines Zuordnungsspiel zu den verschiedenen Orbitalen
Als Eintieg, um sich alles gut merken zu können, eine Wiederholung, was in der interaktiven Darstellung alles zu sehen war.
Folgende Bilder von Orbitalen werden gezeigt: s-Orbital, p-Orbital, sp3-Hybridisierung, sp2-Hybridisierung, σ-Bindung, π-Bindung, Doppelbindung.
Kontrollfragen zum Verständnis
Hinweis: Es kann eine beliebige Anzahl an Antworten richtig sein!
Wie viele Bindungen hat man bei der Überlappung der p-Orbitale? (eine) (!zwei) (!keine)
Wieviele σ-Bindungen gibt es ingesamt? (!eine) (!zwei) (!vier) (fünf)
Was ist mit s-Orbitalen (das 1s und das 2s) bei den Kohlenstoffatomen? (!Die lassen wir beide weg, weil es zu übersichtlich wird.) (Das 1s-Orbital ist voll und kann deshalb keine Bindung ausbilden.) (!Das 2s-Orbital ist voll und kann deshalb keine Bindung ausbilden.) (Das 2s-Orbital gibt es gar nicht.)
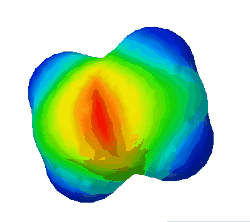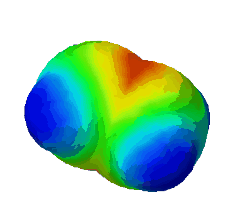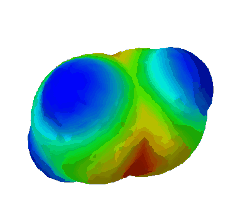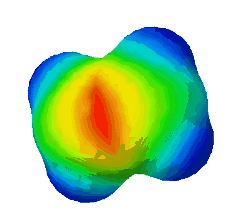
In diesem Bild ist die Elektronendichte bei einem Ethen-Molekül dargestellt. Rot steht für eine hohe Elektronendichte, blau für eine geringe.
Warum sind an zwei Stellen - oben und unten - rote Flecken zu sehen? (Das sind die Elektronen der Pi-Bindung) (!Wegen der Doppelbindung sind dort viele Elektronen.) (!Oben ist die σ-Bindung und unten die π-Bindung.)
Was gilt für alle σ-Bindungen, wie man auch im Bild oben sehen konnte? (!Sie werden immer mit sp³-Orbitalen gebildet.) (!Sie werden nur durch Überlappung von Hybrid-Orbitalen gebildet.) (Sie sind Rotationssymmetrisch um die Verbindung der Kerne angeordnet.) (!Es ist immer ein s-Orbital beteiligt.)
Halte die folgenden wichtigen Informationen fest
Beschriftung sp3-Hybridisierung
|
Skizziere oder drucke dir die Zeichnung rechts aus und beschrifte entsprechend des folgenden Lückentextes. |
Beschriftung Doppelbindung
|
{{{1}}} |