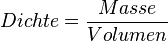Was die Siedetemperatur von Molekülen beeinflusst: Unterschied zwischen den Versionen
(→Dichteanomalie des Wassers) |
(→Dichteanomalie des Wassers) |
||
| Zeile 95: | Zeile 95: | ||
</jmol> | </jmol> | ||
|| | || | ||
| − | || Hier ist eine Anzahl an Wassermoleküle zu sehen und wie sie angeordnet wären, wenn das Wasser im flüssigen Zustand wäre. Es empfiehlt sich gleich, ins Kalottenmodell umzuschalten, damit man eine realistische Vorstellung hat. | + | || Hier ist auch wieder eine gewisse Anzahl an Wassermoleküle zu sehen und wie sie angeordnet wären, wenn das Wasser im flüssigen Zustand wäre. Es empfiehlt sich gleich, ins Kalottenmodell umzuschalten, damit man eine realistische Vorstellung hat. Auch hier sieht man Lücken zwischen den einzelnen Molekülen, aber die Anordnung ist nicht regelmäßig und man kann nicht durchsehen. |
| + | |||
| + | Die Dichte ist in diesem Zustand höher als beim Eis, da weniger Lücken vorhanden sind. | ||
| + | |||
| + | <small>Die gleiche Zeichnung, bei der die Moleküle in Bewegung sind, ist [http://www.chemie.unibas.ch/study/ProTutLern/MolGal/html/cluster.html hier] zu sehen.</small> | ||
|} | |} | ||
| − | Dazu der folgende Film, der den Übergang zwischen Wasser und Eis | + | Dazu der folgende Film, der den Übergang zwischen Wasser und Eis dynamisch in Bewegung zeigt. |
Version vom 18. März 2013, 18:08 Uhr
Inhaltsverzeichnis |
Polarität
Wasserstoffbrückenbindung
Oberflächenspannung
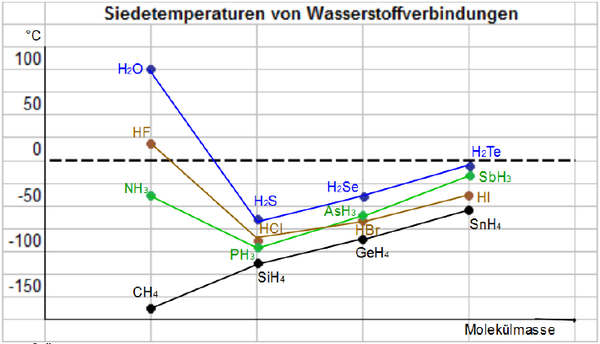
Betrachtet man die Siedetemperaturen von verschiedenen Wasserstoff-Verbindungen, so zeigt sich deutlich die Wirkung der Wasserstoffbrückenbindung und ihre Auswirkung auf die Werte.
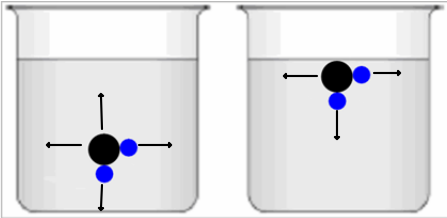
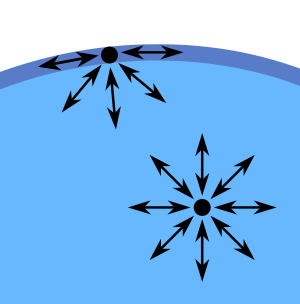
Weitere Bilder zur Oberflächenspannung:


Übrigens gibt es noch einen Stoff, der eine höhere Oberflächenspannung hat als Wasser, nämlich Quecksilber. Man erkennt dies an den typischen runden Tröpfchen, die Quecksilber auch auf einem Untergrund ausbildet.
Dar Grund für die diese hohe Oberflächenspannung ist aber nicht eine Wasserstoffbrückenbindung. Vielmehr hat es damit zu tun, dass Quecksilber ein Metall ist. De Zusammenhalt der einzelnen Atome geschieht durch eine sogenannte Metallbindung, bei der sich quasi eine Kugelwolke um alle Atomkerne bildet.
Die Flash-Lerngeschichte ![]() Die Oberflächenspannung des Wassers erläutert die Ursache der Oberflächen-Spannung noch einmal ausführlich.
Die Oberflächenspannung des Wassers erläutert die Ursache der Oberflächen-Spannung noch einmal ausführlich.
Dichteanomalie des Wassers
Wasser zeigt eine Besonderheit, wenn man die Dichte bei verschiedenen Temperaturen betrachtet. Eine Besonderheit, die es bei keinem anderen Stoff in der Art gibt. Üblicherweise ist es so, dass sich die Dichte eines Stoffes bei sinkender Temperatur erhöht. Grund dafür ist, dass die Teilchen bei sinkenden Temperaturen immer langsamer werden und dadurch näher zusammenrücken können. Da sich dabei das Volumen verringert, wird die Dichte größer, denn die Dichte wird ja berechnet durch
Bei Wasser ist das nicht so. Es hat seine höchste Dichte bei 4°C. Dagegen ist die Dichte bei festem Wasser, also Eis, sehr viel geringer. Hexan verhält sich "normal". Man erkennt, dass die Dichte sich mit der Temperatur kontinuierlich verändert: Je wärmer, desto kleiner wird die Dichte, denn bei einer schnelleren Bewegung brauchen die Teilchen mehr Platz, das Volumen vergrößert sich und so wird der Bruch kleiner.
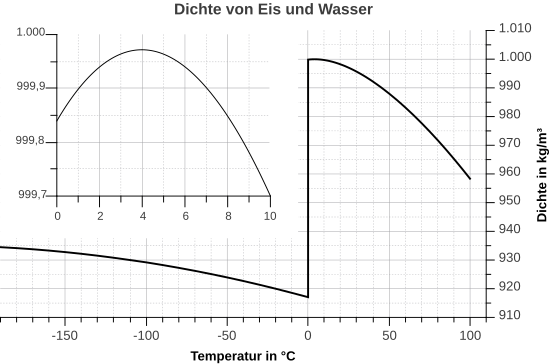
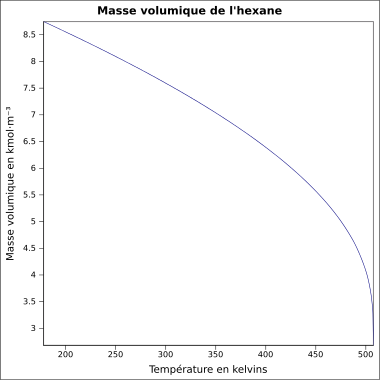
Im Film zeigt sich dies deutlicher. Man vergleicht das Verhalten von Wasser, mit Wachs und Eisessig (99%iger Essig). Weil die Dichte von Eis geringer ist als die Dichte des umgebenden Wassers kann es im Wasser schwimmen. Beim Wachse und beim Eisessig ist es anders. Die Dichte der Feststoffe ist größer als die der Flüsigkeiten und deshalb gehen sie unter.
Auch dieses Wasserphänomen lässt sich mit Hilfe der Wasserstoffbrücken erklären.
Die zwei folgenden dynamischen Zeichnungen zeigen einmal Eis und zum anderen Wasser-Moleküle, die in Bewegung sind.
|
Zur Bedienung: Mit der linken Maustaste kannst du die Darstellung in alle Richtungen drehen, mit dem Mausrad vergrößern und verkleinern, per Rechtsklick kannst du das Menü aufrufen und die Darstellung verändern. Erklärungen: Man sieht eine recht große Anzahl an Wassermolekülen. Sie sind regelmäßig angeordnet, was sich daraus ergibt, dass je ein Wasserstoff-Atom mit einem der freien Elektronenpaare des Sauerstoff eines anderen Wassermoleküls über eine Wasserstoffbrücke miteinander "verbunden" sind. Diese starre Anordnung würde es aber in Realität nicht geben, da die Teilchen auch im gefrorenen Zustand immer ein wenig in Bewegung sind und auf der Stelle schwingen. Die Wasserstoffbrücken halten die Wassermoleküle aber trotzdem an der Stelle und bewirken die regelmäßige Anordnung. Die Wasserstoffbrücken sind hier noch nicht zu sehen, so können aber sichtbar gemacht werden.
Man hat eine Struktur, die von einigen Seiten sechseckige Löcher zeigt. Man also große Lücken, wodurch das Volumen größer und die Dichte geringer ist, als wenn die Moleküle beim flüssigen Wasser quasi lückenlos aneinander liegen.
Nun sieht man, dass sich die Moleküle tatsächlich alle berühren. Man kann kaum zwischen der Bindung zwischen den Atomen und den Wasserstoffbrückenbindungen unterscheiden. Trotzdem sind immer noch Lücken vorhanden! Download der CML-Datei, um sie im Programm Avogadro genauer anschauen zu können. | ||
| Hier ist auch wieder eine gewisse Anzahl an Wassermoleküle zu sehen und wie sie angeordnet wären, wenn das Wasser im flüssigen Zustand wäre. Es empfiehlt sich gleich, ins Kalottenmodell umzuschalten, damit man eine realistische Vorstellung hat. Auch hier sieht man Lücken zwischen den einzelnen Molekülen, aber die Anordnung ist nicht regelmäßig und man kann nicht durchsehen.
Die Dichte ist in diesem Zustand höher als beim Eis, da weniger Lücken vorhanden sind. Die gleiche Zeichnung, bei der die Moleküle in Bewegung sind, ist hier zu sehen. |
Dazu der folgende Film, der den Übergang zwischen Wasser und Eis dynamisch in Bewegung zeigt.
Erklärung: Beim Abkühlen bewegen sich die Wassermoleküle immer langsamer. Die relativ starke Wasserstoffbrücken-Bindung bewirkt die Anordnung der Moleküle in dem sechseckigen Wabengitter. Wird dagegen wieder erhitzt, so wird die Bewegung der Teilchen zu schnell, das Gitter zerfällt und die Wassermoleküle haben keinen festen Platz mehr. Sie sind enger beieinander und so hat das Wasser bei einer Temperatur knapp über dem Gefrierpunkt ein höhere Dichte (also kleineres Volumen). Beim Abkühlen nehmen die Wassermoleküle wieder von alleine die Position im Wabengitter ein.
Bedeutung der Wasserstoff-Brücken in Bio-Molekülen
- Proteine: Stabilisierung von Sekundärstrukturelementen wie α-Helix und β-Faltblatt, sowie der Tertiärstruktur und Quartärstruktur.
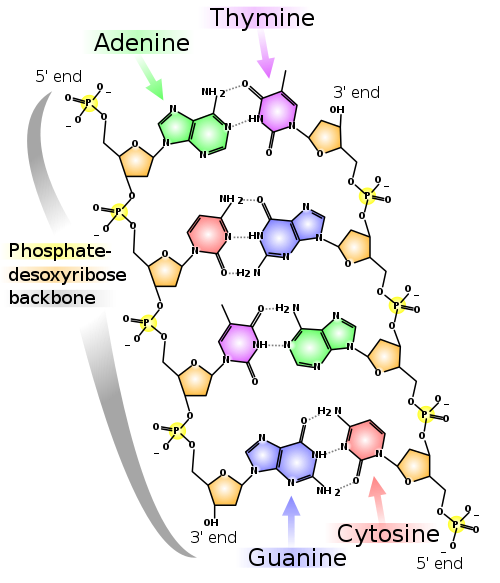
- DNA: komplementäre Basenpaarung innerhalb der Doppelhelix; die beiden DNA-Stränge werden von den Wasserstoffbrückenbindungen zusammengehalten.