|
|
| Zeile 43: |
Zeile 43: |
| | === Experimente zu Energie bei chemischen Reaktionen === | | === Experimente zu Energie bei chemischen Reaktionen === |
| | | | |
| − | Aus dem Buch hast du schon ein paar neue Begriffe zum Energieumsatz bei chemischen Reaktionen kennengelernt. Nun sollst du ein paar Reaktionen selber durchführen und dabei besonders auf die Umsetzung Energie achten. Einige Experimente gibt es nur als Videos. | + | Aus dem Buch hast du schon ein paar neue Begriffe zum Energieumsatz bei chemischen Reaktionen kennengelernt. Nun sollst du ein paar Reaktionen selber durchführen und dabei besonders auf die Umsetzung Energie achten. Einige Experimente gibt es nur als Videos. Alle Anleitungen gibt es auf der Unterseite [[/Experimente zur Energie bei chemischen Reaktionen/]] |
| − | [[Datei:Hydrating-copper(II)-sulfate.jpg|right|300px]]
| + | |
| − |
| + | |
| − | {{Vorlage:VersuchTitel|Kupfersulfat und Wasser|2=<span style="color:#ff0000">'''Verwende bei beiden Versuchen eine Schutzbrille!
| + | |
| − | | + | |
| − | ACHTUNG: {{wpde|Kupfersulfat|Kupfersulfat}} ist umweltgefährdend und darf deshalb nicht in den Abfluss! Hände nach dem Experiment waschen.'''</span>
| + | |
| − | | + | |
| − | '''Versuch 1:''' Erhitze in einem waagrecht eingespannten Reagenzglas etwas "blaues Kupfersulfat" (''= Kupfersulfat-Hydrat''). Beobachte die Farbe des Pulvers bzw. deren Veränderung und die Wand des Reagenzglases im nicht erhitzten Teil.
| + | |
| − | | + | |
| − | '''Versuch 2:''' Versetze in einer kleinen Porzellanschale eine Spatelspitze weißes Kupfersulfat mit <u>wenigen</u> Wassertropfen aus der Plastikpipette und beobachte die Veränderung von Farbe und Temperatur!
| + | |
| − | | + | |
| − | Nutze die aufgebauten Geräte und schaue dir noch einmal die Bilder an, die zeigen, wie das Experiment durchgeführt werden soll.
| + | |
| − | | + | |
| − | '''Aufräumen:''' Gib das erhitzte bzw. mit Wasser versetzte Kupfersulfat jeweils in das passende Behältnis und "lege" wieder alle Geräte zurück. Ein Auswaschen ist notwendig. Es reicht die Reste aus zu schütten/klopfen/kratzen.
| + | |
| − | }}
| + | |
| − | | + | |
| − | | + | |
| − | {{Vorlage:VersuchTitel|Verschiedene Metallpulver verglühen lassen|2=Du sollst in diesem Experiment vergleichen, wie heftig die Reaktion verschiedener Metalle beim Verbrennen ist. <span style="color:#ff0000">'''Schutzbrille verwenden! Sind die Hände gewaschen?'''</span>
| + | |
| − | | + | |
| − | Dazu soll das Metallpulver in die Bunsenbrennerflamme gepustet werden. Gehe jeweils so vor:
| + | |
| − | * Entzünde beim ersten Man den Bunsenbrenner. bzw. öffne die Luftzufuhr, damit du eine rauschende Flamme hast.
| + | |
| − | * Nimm etwas Pulver eines der Metalle in das kürzere abgeknickte Ende des Strohhalm auf.
| + | |
| − | * Umschließe mit der Hand die andere Öffnung des Strohhalms, so dass du durch deine Hand in den Strohhalm pusten kannst.
| + | |
| − | * Richte die untere Öffnung des Strohhalms auf die Flamme. Puste dann das Metallpulver in die Flamme und beobachte die Heftigkeit der Reaktion. <span style="color:#ff0000">'''Es darf niemand "hinter" der Flamme stehen, so dass du ihn anpustest!'''</span>
| + | |
| − | | + | |
| − | '''Für jedes Metall sollte ein eigener Strohhalm vorhanden sein! Bitte geht sparsam mit dem Material um. Das Metallpulver ist nicht so sehr billig! ''Pro Metall sollten zwei Versuche mit kleinen Mengen reichen!'''''
| + | |
| − | | + | |
| − | '''Aufräumen:''' Kehrt den Bereich des Experimentes, damit kein Metallpulver mehr herumliegt. Schaltet den Bunsenbrenner ganz aus, wenn keine Gruppe direkt nach euch dran ist.
| + | |
| − | }}
| + | |
| − | | + | |
| − | | + | |
| − | {{Vorlage:VersuchTitel|Vergleich der Reaktion verschiedener Metalle mit Schwefel|Schau dir die folgenden Experimente an, bei denen Schwefel mit verschiedenen Metallen reagiert.
| + | |
| − | | + | |
| − | Du findest auf den verlinkten Seiten jeweils den Film sowie noch einmal Bilder aus dem Film, wo die wichtigsten Momente noch einmal festgehalten sind. Es lohnt sich meist die Filme größere anzuschauen und auch die Bilder darunter noch einmal zu betrachten und die Erklärungen durchzulesen.
| + | |
| − | | + | |
| − | {{Video}} [http://www.trinkwasserhilfe.de/klawonn/Chemie/mgs.htm Magnesium], [http://www.trinkwasserhilfe.de/klawonn/Chemie/cus.htm Kupfer], [http://www.trinkwasserhilfe.de/klawonn/Chemie/fes.htm Eisen], [http://www.trinkwasserhilfe.de/klawonn/Chemie/ags.htm Silber], [http://www.trinkwasserhilfe.de/klawonn/Chemie/zns.htm Zink].
| + | |
| − | }}
| + | |
| − | | + | |
| − | | + | |
| − | {{Vorlage:VersuchTitel|Kettenreaktion|Betrachte dir dieses Video, in dem man eine Kettenreaktion beobachten kann. {{Video}}{{#ev:youtube|FQGtpo2IUxA}}
| + | |
| − | | + | |
| − | '''Überlege dir dazu folgendes und notiere es:'''
| + | |
| − | * Wenn man das Verbrennen aller Streichhölzer von weit entfernt betrachten würde, kann man nicht die einzelnen Streichhölzer erkennen. Man könnte den Vorgang dann als eine chemische Reaktion betrachten. Ist diese Reaktion dann exotherm oder endotherm.
| + | |
| − | * Welche Bedeutung hat das Entzünden des ersten Streichholzes? Wie trägt das Entzünden jedes einzelnen Streichholzes zur Fortsetzung der "Reaktion" bei?
| + | |
| − | }}
| + | |
| − | | + | |
| − | | + | |
| − | [[Datei:Verbrennung eines Zuckerwürfels_.png|right|400px]]
| + | |
| − | {{Vorlage:VersuchTitel|Zucker verbrennt mit Hilfe von Asche|2=<span style="color:#ff0000">'''Verwende bei beiden Versuchen eine Schutzbrille!'''</span>
| + | |
| − | | + | |
| − | Nimm eines der frischen Würfelzuckerstückchen.
| + | |
| − | | + | |
| − | '''Versuch 1:''' Nutze den kleinen Gasbrenner und versuche den Zucker auf der unbrennbaren Unterfläche zu entzünden, indem du ihn stark erhitzt.
| + | |
| − | | + | |
| − | '''Versuch 2:''' Gib nun etwas von der Asche auf das Zuckerstücken und versuche erneut den Zucker entzünden. Es sollte kein Haufen Asche sein, sondern dünn über die Zuckeroberfläche verteilt werden.
| + | |
| − | | + | |
| − | Ein ähnliches Experiment kannst du dir {{Video}} [http://www.youtube.com/watch?v=wsua-LVPTQA hier] ansehen. Das solltest du auch tun, da man hier noch besser die Wirkung der Asche beobachten kann.
| + | |
| − | }}
| + | |
| − | | + | |
| − | | + | |
| − | Die folgenden Aufgaben sollen gemeinsam im Unterricht bearbeitet werden. Du musst dich aber etwas vorbereiten. Wenn du die wichtigsten Begriffe aus dem Buch herausgesucht und eine Definition - so wie du es verstanden hast - festgehalten hast, schaue sie dir noch einmal an. Die Experimente haben mit chemischen Reaktionen und Energie zu tun und sollten dir helfen, diese neuen Begriffe und Definitionen zu verstehen. Folgende Begriffe solltest du gefunden haben:
| + | |
| − | | + | |
| − | {{Kurzregel|Begriffe, die bei der Betrachtung des Energieumsatzes bei chemischen Reaktionen einen Rolle spielen:
| + | |
| − | * innere/chemische Energie, exotherm, endotherm, Aktivierungsenergie, Katalysator, Energiediagramm}}
| + | |
| − | | + | |
| − | | + | |
| − | {{AufgabeNr|XX|'''Zeichnet Energiediagramme für die Reaktionen von Zink mit Schwefel und Silber mit Schwefel.'''
| + | |
| − | | + | |
| − | Zusatzaufgaben:
| + | |
| − | * Schreibt vorher noch die Reaktionschemata auf.
| + | |
| − | * Klärt, was Energiediagramme sind und wie man sie verstehen muss.
| + | |
| − | * Die beiden Diagramme müssen zusammenpassen. Man darf sie nicht einzeln betrachten! Warum ist das so?
| + | |
| − | }}
| + | |
| − | | + | |
| − | | + | |
| − | | + | |
| − | {{AufgabeNr|XX|'''In dem einen Film wird die Reaktion von Silber mit Schwefel gezeigt und auch gezeigt, dass man die Reaktion rückgängig machen kann. Warum ist die Zerlegung von Silbersulfid im Labor auf diese Weise möglich, nicht aber die Zerlegung von Magnesiumsulfid.'''
| + | |
| − | | + | |
| − | Hilfsaufgaben:
| + | |
| − | * Zeichnet ein Energiediagramm, in dem die Hin- und die Rückreaktion von Silber und Schwefel verdeutlicht werden.
| + | |
| − | * Wie sieht das entsprechende Energiediagramm zu Magnesium und Schwefel aus?
| + | |
| − | }}
| + | |
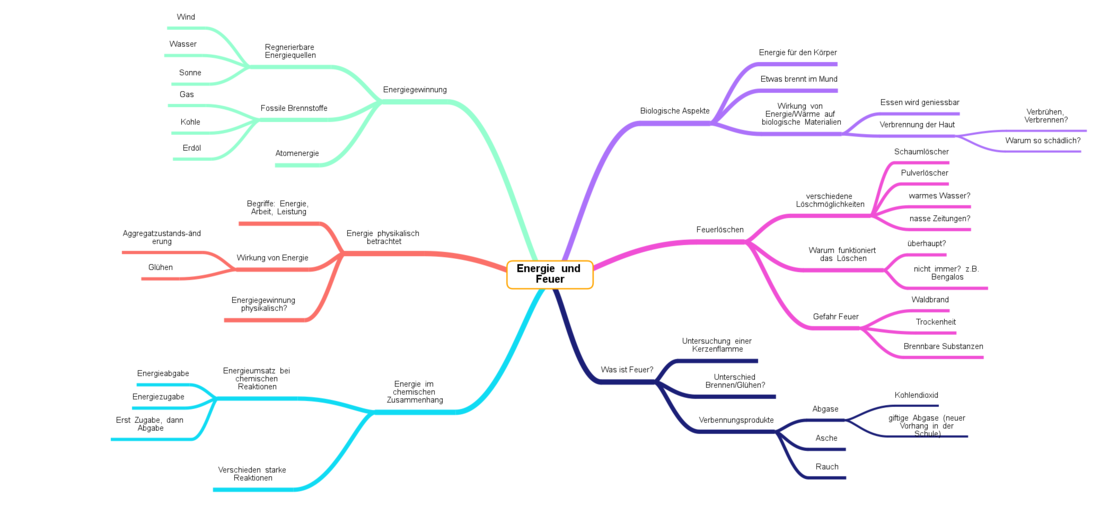
Nachdem wir ein paar Ideen zum Thema gesucht haben, hier eine Übersicht der Themen, ein wenig sinnvoll sortiert.
Auf der Unterseite geht es um alltägliche Vorgänge, bei denen der Energieumsatz wichtig ist. Du sollst aus der Beschreibung den Texten herauslesen, ob es ein Vorgang mit Energieaufnahme oder -abgabe ist. Wichtige Vorgänge mit Energieumsatz
Aus dem Buch hast du schon ein paar neue Begriffe zum Energieumsatz bei chemischen Reaktionen kennengelernt. Nun sollst du ein paar Reaktionen selber durchführen und dabei besonders auf die Umsetzung Energie achten. Einige Experimente gibt es nur als Videos. Alle Anleitungen gibt es auf der Unterseite Experimente zur Energie bei chemischen Reaktionen