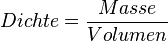Was die Siedetemperatur von Molekülen beeinflusst: Unterschied zwischen den Versionen
(→Dichteanomalie des Wassers) |
(→Dichteanomalie des Wassers) |
||
| (28 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 2: | Zeile 2: | ||
| + | * [http://www.librairiedemolecules.education.fr/outils/scribmol/scrib.html Online-Werkzeug] zum Zeichnen von Molekülen und Untersuchung der Polarität | ||
| + | ::[https://www.youtube.com/watch?v=9VsoweXqhp8 Kurzanleitung] für Schüler | ||
== Wasserstoffbrückenbindung == | == Wasserstoffbrückenbindung == | ||
| Zeile 15: | Zeile 17: | ||
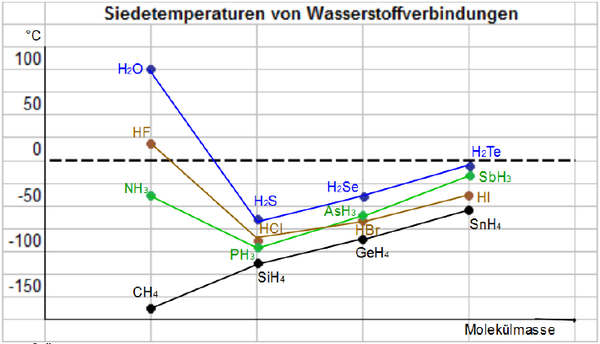
Betrachtet man die Siedetemperaturen von verschiedenen Wasserstoff-Verbindungen, so zeigt sich deutlich die Wirkung der Wasserstoffbrückenbindung und ihre Auswirkung auf die Werte. | Betrachtet man die Siedetemperaturen von verschiedenen Wasserstoff-Verbindungen, so zeigt sich deutlich die Wirkung der Wasserstoffbrückenbindung und ihre Auswirkung auf die Werte. | ||
<center>[[Datei:Siedetemperaturen mit H-Brücke.png|600px]]</center> | <center>[[Datei:Siedetemperaturen mit H-Brücke.png|600px]]</center> | ||
| + | |||
| + | |||
| + | |||
| + | Eine kleine Amination, um die Wirkung der Wasserstoff-Brücken-Bindung zu zeigen: | ||
| + | |||
| + | {{#ev:youtube|NWAsuGSppyM|500}} | ||
| + | |||
| + | |||
<center>[[Datei:Anziehung Wasserteilchen.png]] [[File:WassermoleküleInTröpfchen-2.svg]]</center> | <center>[[Datei:Anziehung Wasserteilchen.png]] [[File:WassermoleküleInTröpfchen-2.svg]]</center> | ||
| Zeile 33: | Zeile 43: | ||
=== Dichteanomalie des Wassers === | === Dichteanomalie des Wassers === | ||
| − | Wasser zeigt eine Besonderheit, wenn man die Dichte bei verschiedenen Temperaturen betrachtet. Eine Besonderheit, die es bei keinem anderen Stoff in der Art gibt. Üblicherweise ist es so, dass sich die Dichte eines Stoffes bei sinkender Temperatur erhöht. Grund dafür ist, dass die Teilchen bei sinkenden Temperaturen immer langsamer werden und dadurch näher zusammenrücken können. Da sich dabei das Volumen verringert, wird die Dichte größer, denn die Dichte wird ja berechnet durch | + | Das Eis, also gefrorenes Wasser, auf flüssigem Wasser schwimmt, erscheint und normal. Tatsächlich ist Wasser da eine Ausnahme. Dazu ein Film: |
| + | |||
| + | <center>{{#ev:youtube|OfzbHz1e12E}} </center> | ||
| + | |||
| + | {{AufgabeNr|XX|Halte folgendes im Heft fest: | ||
| + | # Die Überschrift dieses Abschnitts. | ||
| + | # Wie sich die Dichten von Eis und Wasser im Gegensatz zu den zwei anderen Stoffen verhalten. | ||
| + | |||
| + | |||
| + | }} | ||
| + | |||
| + | |||
| + | <!--Man vergleicht das Verhalten von Wasser, mit Wachs und Eisessig (99%iger Essig). Weil die Dichte von Eis geringer ist als die Dichte des umgebenden Wassers, kann es im Wasser schwimmen. Beim Wachs und beim Eisessig ist es anders. Die Dichte der beiden Feststoffe ist größer als die der entsprechenden Flüsigkeiten und deshalb gehen sie unter.--> | ||
| + | |||
| + | |||
| + | Wasser zeigt damit eine Besonderheit, wenn man die Dichte bei verschiedenen Temperaturen betrachtet. Eine Besonderheit, die es bei keinem anderen Stoff in der Art gibt. Üblicherweise ist es so, dass sich die Dichte eines Stoffes bei sinkender Temperatur erhöht. Grund dafür ist, dass die Teilchen bei sinkenden Temperaturen immer langsamer werden und dadurch näher zusammenrücken können. Da sich dabei das Volumen verringert, wird die Dichte größer, denn die Dichte wird ja berechnet durch | ||
* <math>Dichte = \frac{Masse}{Volumen}</math> | * <math>Dichte = \frac{Masse}{Volumen}</math> | ||
| + | <center>[[File:Teilchenmodell Gas.svg|350px]] [[File:Teilchenmodell Fluessigkeit.svg|350px]]</center> | ||
| − | Bei Wasser ist das nicht so. Es hat seine höchste Dichte bei 4°C. Dagegen ist die Dichte bei festem Wasser, also Eis, sehr viel geringer. Hexan verhält sich "normal". Man erkennt, dass die Dichte sich mit der Temperatur kontinuierlich verändert: Je wärmer, desto kleiner wird die Dichte, denn bei einer schnelleren Bewegung brauchen die Teilchen mehr Platz, das Volumen vergrößert sich und so wird der Bruch kleiner. | + | Bei Wasser ist das nicht so. Es hat seine höchste Dichte bei 4°C. Dagegen ist die Dichte bei festem Wasser, also Eis, sehr viel geringer. Hexan zum Beispiel verhält sich "normal". Man erkennt, dass die Dichte sich mit der Temperatur kontinuierlich verändert: Je wärmer, desto kleiner wird die Dichte, denn bei einer schnelleren Bewegung brauchen die Teilchen mehr Platz, das Volumen vergrößert sich und so wird der Bruch kleiner. |
| − | <center>[[File: | + | <center>[[File:Masse volumique hexane.svg|380px]] [[File:Density_of_ice_and_water_%28de%29.svg|550px]]</center> |
| + | |||
| − | |||
| − | |||
{| | {| | ||
| Zeile 53: | Zeile 78: | ||
|} | |} | ||
| − | Auch dieses Wasserphänomen lässt sich mit Hilfe der Wasserstoffbrücken erklären. | + | Auch dieses Wasserphänomen lässt sich mit Hilfe der Wasserstoffbrücken erklären. |
| − | + | Dazu der folgende Film, der den Übergang zwischen Wasser zu Eis dynamisch in Bewegung zeigt. | |
| − | Die zwei folgenden | + | |
| + | <center>{{#ev:youtube|bOPJ2_jb22E|550}} </center> | ||
| + | |||
| + | '''Erklärung:''' Beim Abkühlen bewegen sich die Wassermoleküle immer langsamer. Die relativ starke Wasserstoffbrücken-Bindung bewirkt die Anordnung der Moleküle in dem sechseckigen Wabengitter. | ||
| + | |||
| + | Wird dagegen wieder erhitzt, so wird die Bewegung der Teilchen zu schnell, das Gitter zerfällt und die Wassermoleküle haben keinen festen Platz mehr. Sie sind enger beieinander und so hat das Wasser bei einer Temperatur knapp über dem Gefrierpunkt ein höhere Dichte (also kleineres Volumen). Beim Abkühlen nehmen die Wassermoleküle wieder von alleine die Position im Wabengitter ein. | ||
| + | |||
| + | |||
| + | |||
| + | Die zwei folgenden drehbaren Zeichnungen zeigen einmal Eis und zum anderen Wasser-Moleküle, die in Bewegung sind. | ||
{| | {| | ||
|- | |- | ||
| − | | | + | | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
|| || | || || | ||
| − | ''' | + | |
| + | Ein bewegliches Bild bekommst du auf der [[/Wassermoleküle geordnet/|Unterseite]] ''(denn leider kann die Extension zur Darstellung von 3D-Molekülen im Moment nur ein Bild pro Seite darstellen)''. | ||
'''Erklärungen:''' Man sieht eine recht große Anzahl an Wassermolekülen. Sie sind regelmäßig angeordnet, was sich daraus ergibt, dass je ein Wasserstoff-Atom mit einem der freien Elektronenpaare des Sauerstoff eines anderen Wassermoleküls über eine Wasserstoffbrücke miteinander "verbunden" sind. Diese starre Anordnung würde es aber in Realität nicht geben, da die Teilchen auch im gefrorenen Zustand immer ein wenig in Bewegung sind und auf der Stelle schwingen. Die Wasserstoffbrücken halten die Wassermoleküle aber trotzdem an der Stelle und bewirken die regelmäßige Anordnung. | '''Erklärungen:''' Man sieht eine recht große Anzahl an Wassermolekülen. Sie sind regelmäßig angeordnet, was sich daraus ergibt, dass je ein Wasserstoff-Atom mit einem der freien Elektronenpaare des Sauerstoff eines anderen Wassermoleküls über eine Wasserstoffbrücke miteinander "verbunden" sind. Diese starre Anordnung würde es aber in Realität nicht geben, da die Teilchen auch im gefrorenen Zustand immer ein wenig in Bewegung sind und auf der Stelle schwingen. Die Wasserstoffbrücken halten die Wassermoleküle aber trotzdem an der Stelle und bewirken die regelmäßige Anordnung. | ||
| Zeile 80: | Zeile 110: | ||
Man hat eine Struktur, die von einigen Seiten sechseckige Löcher zeigt. Man also große Lücken, wodurch das Volumen größer und die Dichte geringer ist, als wenn die Moleküle beim flüssigen Wasser quasi lückenlos aneinander liegen. | Man hat eine Struktur, die von einigen Seiten sechseckige Löcher zeigt. Man also große Lücken, wodurch das Volumen größer und die Dichte geringer ist, als wenn die Moleküle beim flüssigen Wasser quasi lückenlos aneinander liegen. | ||
| − | + | '''WICHTIG:''' Die hier zu sehende Darstellung, dass die Moleküle einen großen Abstand voneinander haben, ist natürlich alles andere als realistisch. Die hier zu sehende sogenannte '''Kugel-Stab-Darstellung''' kann man so verstehen, dass die Kugeln für die Atomkerne stehen, die Stäbe für die Bindungen. Tatsächlich haben wir ja bei den Atombindungen eine Überlagerung der Atomhüllen. Dies wird besser in einer anderen Darstellung, dem sogenannten '''Kalottenmodell''' verdeutlicht. Ein einzelnes Wassermolekül sieht dann so aus, wie im Bild rechts. Die Wassermoleküle hier kann man auch alle im Kalottenmodell anzeigen lassen. [[File:H2o.png|right|80px|Kalottenmodell vom Wassermolekül]] | |
| − | + | * Im Menü auf "Stil" dann auf "Schema". Dort wird die Einstellung "Kalotten" ausgewählt. Man kann die alte Ansicht wieder zurückholen, indem man an gleicher Stelle die Einstellung "Kugel-Stab" auswählt. | |
| − | * Im Menü "Stil" dann auf "Schema". Dort wird die Einstellung "Kalotten" ausgewählt. Man kann die alte Ansicht wieder zurückholen, indem man an gleicher Stelle die Einstellung "Kugel-Stab" auswählt. | + | |
Nun sieht man, dass sich die Moleküle tatsächlich alle berühren. Man kann kaum zwischen der Bindung zwischen den Atomen und den Wasserstoffbrückenbindungen unterscheiden. Trotzdem sind immer noch Lücken vorhanden! | Nun sieht man, dass sich die Moleküle tatsächlich alle berühren. Man kann kaum zwischen der Bindung zwischen den Atomen und den Wasserstoffbrückenbindungen unterscheiden. Trotzdem sind immer noch Lücken vorhanden! | ||
| Zeile 96: | Zeile 125: | ||
</jmolApplet> | </jmolApplet> | ||
</jmol> | </jmol> | ||
| − | || | + | || |
| − | || Hier ist eine | + | || Hier ist auch wieder eine gewisse Anzahl an Wassermoleküle zu sehen und wie sie angeordnet wären, wenn das Wasser im flüssigen Zustand wäre. Es empfiehlt sich gleich, ins Kalottenmodell umzuschalten, damit man eine realistische Vorstellung hat. |
| − | + | ||
| + | Auch hier berühren sich die Moleküle und sieht man auch Lücken zwischen den einzelnen Molekülen, aber die Anordnung ist nicht regelmäßig und man kann nicht durchsehen. | ||
| + | Die Dichte ist in diesem Zustand höher als beim Eis, da weniger Lücken vorhanden sind. | ||
| + | <small>Die gleiche Zeichnung, bei der die Moleküle in Bewegung sind, ist [http://www.chemie.unibas.ch/study/ProTutLern/MolGal/html/cluster.html hier] zu sehen.</small> | ||
| + | |} | ||
| − | + | Eine weitere Darstellung für den Übergang zwischen Wasser und Eis wird auf [http://biomodel.uah.es/en/water/p3.htm dieser Seite] gezeigt. | |
| + | |||
| + | {{Buch|Wasserstoffbrückenbindung und Dichteanomalie|den Seiten 221 und 222}} | ||
=== Bedeutung der Wasserstoff-Brücken in Bio-Molekülen === | === Bedeutung der Wasserstoff-Brücken in Bio-Molekülen === | ||
| Zeile 115: | Zeile 149: | ||
== Van der Waals-Kräfte == | == Van der Waals-Kräfte == | ||
| + | |||
| + | |||
| + | |||
| + | {| | ||
| + | |- | ||
| + | | | ||
| + | <jmol> | ||
| + | <jmolApplet> | ||
| + | <size>300</size> | ||
| + | <uploadedFileContents>Hexan.cml</uploadedFileContents> | ||
| + | </jmolApplet> | ||
| + | </jmol> | ||
| + | | | ||
| + | <jmol> | ||
| + | <jmolApplet> | ||
| + | <size>300</size> | ||
| + | <uploadedFileContents>Iso-Hexan.cml</uploadedFileContents> | ||
| + | </jmolApplet> | ||
| + | </jmol> | ||
| + | |- | ||
| + | | '''Hexan''' C<sub>6</sub>H<sub>14</sub> | ||
| + | | '''2,3-Dimethylbutan''' C<sub>6</sub>H<sub>14</sub> | ||
| + | |- | ||
| + | | Siedetemperatur = 69 °C | ||
| + | | Siedetemperatur = 58 °C | ||
| + | |} | ||
| + | |||
| + | |||
| + | |||
| + | === Woher kommt die Anziehung zwischen neutralen Molekülen ? === | ||
| + | |||
| + | Dazu passend ein Ausschnitt aus dem [http://www.br.de/telekolleg/faecher/chemie/telekolleg-chemie-03-112.html Telekolleg Chemie] | ||
| + | |||
| + | {{AufgabeNr|1|2=Halte im Heft unter der Überschrift ''"Wie aus einem unpolaren Atom ein Dipol werden kann"'' die Antworten zu folgenden Fragen fest: | ||
| + | * Wieso kann eine Polarisierung entstehen? | ||
| + | * Warum bleibt die Polarisierung nicht erhalten? | ||
| + | * Warum wirkt sich die Polarisierung auf ein anderes Atom aus? | ||
| + | * Beschreibe die Begriffe '''temporärer Dipol''' und '''induzierter Dipol''' ''(induzieren = hervorrufen)''. | ||
| + | }} | ||
| + | |||
| + | === Vergleich der Anziehungskräfte von zwei Dipolen und den Van-der-Waals-Kräfte === | ||
| + | |||
| + | {{AufgabeNr|2|2=Für den Vergleich steht eine kleine [http://chemsite.lsrhs.net/FlashMedia/html/dipoleVsLondon.html Anwendung] zur Verfügung. | ||
| + | |||
| + | Notiere deine Beobachtungen zu den drei Knöpfen: | ||
| + | * instantaneous view = '''Momentaufnahme''' | ||
| + | * freeze time = '''eingefrorener Zustand''' | ||
| + | * average over time = '''zeitlicher Durchschnitt''' | ||
| + | }} | ||
| + | |||
| + | |||
| + | === Betrachten der Oberfläche der zwei Moleküle === | ||
| + | |||
| + | |||
| + | {| | ||
| + | |- | ||
| + | | | ||
| + | <jmol> | ||
| + | <jmolApplet> | ||
| + | <size>300</size> | ||
| + | <uploadedFileContents>Hexan.cml</uploadedFileContents> | ||
| + | <script> | ||
| + | select *; calculate partialcharge; isosurface resolution 0 vdw color range -.07 .07 map mep translucent; | ||
| + | </script> | ||
| + | </jmolApplet> | ||
| + | </jmol> | ||
| + | | | ||
| + | <jmol> | ||
| + | <jmolApplet> | ||
| + | <size>300</size> | ||
| + | <uploadedFileContents>Iso-Hexan.cml</uploadedFileContents> | ||
| + | <script>isosurface solvent;</script> | ||
| + | </jmolApplet> | ||
| + | </jmol> | ||
| + | |- | ||
| + | | '''Hexan''' C<sub>6</sub>H<sub>14</sub> | ||
| + | | '''2,3-Dimethylbutan''' C<sub>6</sub>H<sub>14</sub> | ||
| + | |} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|3|In den Bildern sind die Oberflächen der beiden Moleküle zu sehen. Auch wenn man die Ausmaße der Molekül-Oberfläche nicht genau erkennen kann, solltest aus dem Mathematik-Unterricht wissen, wie sich die unterschiedliche Form auf die Oberfläche auswirkt. Halte im Heft fest: | ||
| + | :''Beim Hexan ist die Oberfläche ... als beim 2,3-Dimethylbutan. '''Allgemein:''' Lange, unverzweigte Molekül-Ketten haben eine ... Oberfläche als stark verzweigte Ketten.'' }} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|4|Von was und wieso werden vermutlich die Van-der-Waals-Kräfte abhängen? | ||
| + | {{Lösung|Da die Anziehung zwischen den Hexan-Molekülen anscheinend größer ist, hängt dies also mit der Oberfläche zusammen.}}}} | ||
| + | |||
| + | |||
| + | {{Buch|Van-der-Waals-Kräfte allgemein|der Seiten 219}} | ||
| + | {{Buch|Van-der-Waals-Kräfte bei Kohlenwasserstoffen|der Seite 299}} | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | {{Kurzregel|Die Van-der-Waals-Kräfte beruhen auf der Anziehung von Atomen und ungeladenen Molekülen. Ursache sind temporäre Dipole, die in benachbarten Teilchen ebenfalls Dipole induzieren ''(erzeugen)''. Je größer die Oberfläche ist, desto stärker sind die Van-der-Waals-Kräfte. }} | ||
Aktuelle Version vom 3. April 2014, 15:19 Uhr
Inhaltsverzeichnis |
Polarität
- Online-Werkzeug zum Zeichnen von Molekülen und Untersuchung der Polarität
- Kurzanleitung für Schüler
Wasserstoffbrückenbindung
Oberflächenspannung
Betrachtet man die Siedetemperaturen von verschiedenen Wasserstoff-Verbindungen, so zeigt sich deutlich die Wirkung der Wasserstoffbrückenbindung und ihre Auswirkung auf die Werte.
Eine kleine Amination, um die Wirkung der Wasserstoff-Brücken-Bindung zu zeigen:
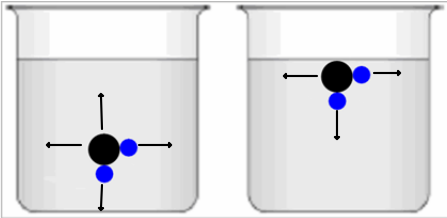
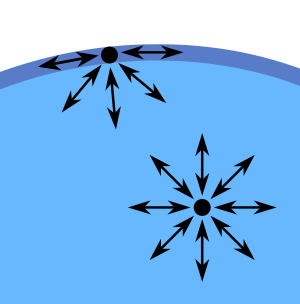
Weitere Bilder zur Oberflächenspannung:


Übrigens gibt es noch einen Stoff, der eine höhere Oberflächenspannung hat als Wasser, nämlich Quecksilber. Man erkennt dies an den typischen runden Tröpfchen, die Quecksilber auch auf einem Untergrund ausbildet.
Dar Grund für die diese hohe Oberflächenspannung ist aber nicht eine Wasserstoffbrückenbindung. Vielmehr hat es damit zu tun, dass Quecksilber ein Metall ist. De Zusammenhalt der einzelnen Atome geschieht durch eine sogenannte Metallbindung, bei der sich quasi eine Kugelwolke um alle Atomkerne bildet.
Die Flash-Lerngeschichte ![]() Die Oberflächenspannung des Wassers erläutert die Ursache der Oberflächen-Spannung noch einmal ausführlich.
Die Oberflächenspannung des Wassers erläutert die Ursache der Oberflächen-Spannung noch einmal ausführlich.
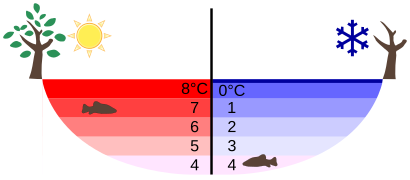
Dichteanomalie des Wassers
Das Eis, also gefrorenes Wasser, auf flüssigem Wasser schwimmt, erscheint und normal. Tatsächlich ist Wasser da eine Ausnahme. Dazu ein Film:
|
Halte folgendes im Heft fest:
|
Wasser zeigt damit eine Besonderheit, wenn man die Dichte bei verschiedenen Temperaturen betrachtet. Eine Besonderheit, die es bei keinem anderen Stoff in der Art gibt. Üblicherweise ist es so, dass sich die Dichte eines Stoffes bei sinkender Temperatur erhöht. Grund dafür ist, dass die Teilchen bei sinkenden Temperaturen immer langsamer werden und dadurch näher zusammenrücken können. Da sich dabei das Volumen verringert, wird die Dichte größer, denn die Dichte wird ja berechnet durch
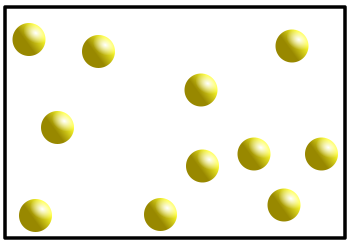
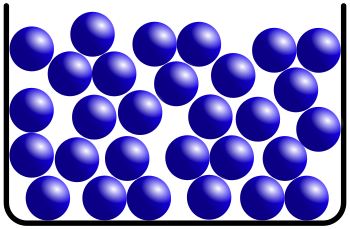
Bei Wasser ist das nicht so. Es hat seine höchste Dichte bei 4°C. Dagegen ist die Dichte bei festem Wasser, also Eis, sehr viel geringer. Hexan zum Beispiel verhält sich "normal". Man erkennt, dass die Dichte sich mit der Temperatur kontinuierlich verändert: Je wärmer, desto kleiner wird die Dichte, denn bei einer schnelleren Bewegung brauchen die Teilchen mehr Platz, das Volumen vergrößert sich und so wird der Bruch kleiner.
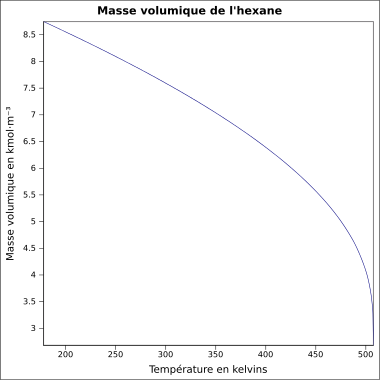
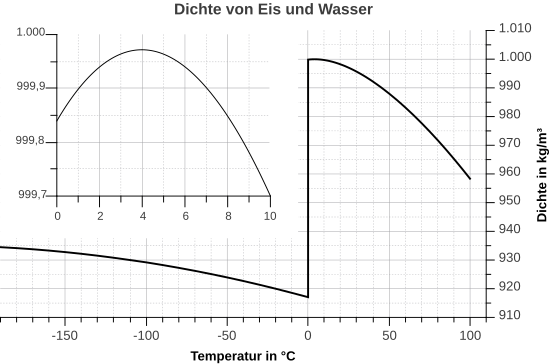
Auch dieses Wasserphänomen lässt sich mit Hilfe der Wasserstoffbrücken erklären.
Dazu der folgende Film, der den Übergang zwischen Wasser zu Eis dynamisch in Bewegung zeigt.
Erklärung: Beim Abkühlen bewegen sich die Wassermoleküle immer langsamer. Die relativ starke Wasserstoffbrücken-Bindung bewirkt die Anordnung der Moleküle in dem sechseckigen Wabengitter.
Wird dagegen wieder erhitzt, so wird die Bewegung der Teilchen zu schnell, das Gitter zerfällt und die Wassermoleküle haben keinen festen Platz mehr. Sie sind enger beieinander und so hat das Wasser bei einer Temperatur knapp über dem Gefrierpunkt ein höhere Dichte (also kleineres Volumen). Beim Abkühlen nehmen die Wassermoleküle wieder von alleine die Position im Wabengitter ein.
Die zwei folgenden drehbaren Zeichnungen zeigen einmal Eis und zum anderen Wasser-Moleküle, die in Bewegung sind.
|
Ein bewegliches Bild bekommst du auf der Unterseite (denn leider kann die Extension zur Darstellung von 3D-Molekülen im Moment nur ein Bild pro Seite darstellen). Erklärungen: Man sieht eine recht große Anzahl an Wassermolekülen. Sie sind regelmäßig angeordnet, was sich daraus ergibt, dass je ein Wasserstoff-Atom mit einem der freien Elektronenpaare des Sauerstoff eines anderen Wassermoleküls über eine Wasserstoffbrücke miteinander "verbunden" sind. Diese starre Anordnung würde es aber in Realität nicht geben, da die Teilchen auch im gefrorenen Zustand immer ein wenig in Bewegung sind und auf der Stelle schwingen. Die Wasserstoffbrücken halten die Wassermoleküle aber trotzdem an der Stelle und bewirken die regelmäßige Anordnung. Die Wasserstoffbrücken sind hier noch nicht zu sehen, so können aber sichtbar gemacht werden.
Man hat eine Struktur, die von einigen Seiten sechseckige Löcher zeigt. Man also große Lücken, wodurch das Volumen größer und die Dichte geringer ist, als wenn die Moleküle beim flüssigen Wasser quasi lückenlos aneinander liegen. WICHTIG: Die hier zu sehende Darstellung, dass die Moleküle einen großen Abstand voneinander haben, ist natürlich alles andere als realistisch. Die hier zu sehende sogenannte Kugel-Stab-Darstellung kann man so verstehen, dass die Kugeln für die Atomkerne stehen, die Stäbe für die Bindungen. Tatsächlich haben wir ja bei den Atombindungen eine Überlagerung der Atomhüllen. Dies wird besser in einer anderen Darstellung, dem sogenannten Kalottenmodell verdeutlicht. Ein einzelnes Wassermolekül sieht dann so aus, wie im Bild rechts. Die Wassermoleküle hier kann man auch alle im Kalottenmodell anzeigen lassen.
Nun sieht man, dass sich die Moleküle tatsächlich alle berühren. Man kann kaum zwischen der Bindung zwischen den Atomen und den Wasserstoffbrückenbindungen unterscheiden. Trotzdem sind immer noch Lücken vorhanden! Download der CML-Datei, um sie im Programm Avogadro genauer anschauen zu können. | ||
| Hier ist auch wieder eine gewisse Anzahl an Wassermoleküle zu sehen und wie sie angeordnet wären, wenn das Wasser im flüssigen Zustand wäre. Es empfiehlt sich gleich, ins Kalottenmodell umzuschalten, damit man eine realistische Vorstellung hat.
Auch hier berühren sich die Moleküle und sieht man auch Lücken zwischen den einzelnen Molekülen, aber die Anordnung ist nicht regelmäßig und man kann nicht durchsehen. Die Dichte ist in diesem Zustand höher als beim Eis, da weniger Lücken vorhanden sind. Die gleiche Zeichnung, bei der die Moleküle in Bewegung sind, ist hier zu sehen. |
Eine weitere Darstellung für den Übergang zwischen Wasser und Eis wird auf dieser Seite gezeigt.

|
Im Buch zu lesen: Zum Thema Wasserstoffbrückenbindung und Dichteanomalie findest du in unserem Buch Informationen auf den Seiten 221 und 222. |
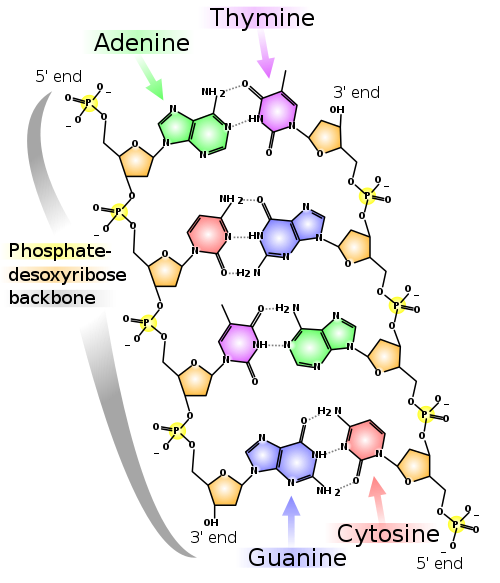
Bedeutung der Wasserstoff-Brücken in Bio-Molekülen
- Proteine: Stabilisierung von Sekundärstrukturelementen wie α-Helix und β-Faltblatt, sowie der Tertiärstruktur und Quartärstruktur.
- DNA: komplementäre Basenpaarung innerhalb der Doppelhelix; die beiden DNA-Stränge werden von den Wasserstoffbrückenbindungen zusammengehalten.
Van der Waals-Kräfte
|
|
|
| Hexan C6H14 | 2,3-Dimethylbutan C6H14 |
| Siedetemperatur = 69 °C | Siedetemperatur = 58 °C |
Woher kommt die Anziehung zwischen neutralen Molekülen ?
Dazu passend ein Ausschnitt aus dem Telekolleg Chemie
|
Halte im Heft unter der Überschrift "Wie aus einem unpolaren Atom ein Dipol werden kann" die Antworten zu folgenden Fragen fest:
|
Vergleich der Anziehungskräfte von zwei Dipolen und den Van-der-Waals-Kräfte
|
Für den Vergleich steht eine kleine Anwendung zur Verfügung. Notiere deine Beobachtungen zu den drei Knöpfen:
|
Betrachten der Oberfläche der zwei Moleküle
|
|
|
| Hexan C6H14 | 2,3-Dimethylbutan C6H14 |
|
In den Bildern sind die Oberflächen der beiden Moleküle zu sehen. Auch wenn man die Ausmaße der Molekül-Oberfläche nicht genau erkennen kann, solltest aus dem Mathematik-Unterricht wissen, wie sich die unterschiedliche Form auf die Oberfläche auswirkt. Halte im Heft fest:
|
|
Von was und wieso werden vermutlich die Van-der-Waals-Kräfte abhängen? Da die Anziehung zwischen den Hexan-Molekülen anscheinend größer ist, hängt dies also mit der Oberfläche zusammen. |

|
Im Buch zu lesen: Zum Thema Van-der-Waals-Kräfte allgemein findest du in unserem Buch Informationen auf der Seiten 219. |

|
Im Buch zu lesen: Zum Thema Van-der-Waals-Kräfte bei Kohlenwasserstoffen findest du in unserem Buch Informationen auf der Seite 299. |
| Die Van-der-Waals-Kräfte beruhen auf der Anziehung von Atomen und ungeladenen Molekülen. Ursache sind temporäre Dipole, die in benachbarten Teilchen ebenfalls Dipole induzieren (erzeugen). Je größer die Oberfläche ist, desto stärker sind die Van-der-Waals-Kräfte. |