Doppelbindung beim Ethen: Unterschied zwischen den Versionen
(→Kleines Zuordnungsspiel zu den verschiedenen Orbitalen) |
(→Kleines Zuordnungsspiel zu den verschiedenen Orbitalen: gelöscht, weil nicht alles zu sehen ist) |
||
| Zeile 110: | Zeile 110: | ||
'''Was gilt für alle σ-Bindungen, wie man auch im Bild oben sehen konnte?''' (!Sie werden immer mit sp³-Orbitalen gebildet.) (!Sie werden nur durch Überlappung von Hybrid-Orbitalen gebildet.) (!Sie sind Rotationssymmetrisch um die Verbindung der Kerne angeordnet.) (!Es ist immer ein s-Orbital beteiligt.) | '''Was gilt für alle σ-Bindungen, wie man auch im Bild oben sehen konnte?''' (!Sie werden immer mit sp³-Orbitalen gebildet.) (!Sie werden nur durch Überlappung von Hybrid-Orbitalen gebildet.) (!Sie sind Rotationssymmetrisch um die Verbindung der Kerne angeordnet.) (!Es ist immer ein s-Orbital beteiligt.) | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
Version vom 1. Mai 2015, 13:47 Uhr
Hinweis zur Bedienung: Das Molekül lässt sich mit der Maus (linke Maustaste) drehen. Mit dem Mausrad kann man hinein und hinaus scrollen.
|
|
Darstellung und Sonstiges:
Hinweis: Leider werden bei einem Atom immer alle Orbitale gelöscht, d.h. wenn man ein Orbital löscht werden alle gelöscht. Betrachtung der Orbitale bei einem Kohlenstoff-Atom und dem damit verbundenen H-Atom:
|
Kontrollfragen zum Verständnis
Hinweis: Es kann eine beliebige Anzahl an Antworten richtig sein!
Wie viele Bindungen hat man bei der Überlappung der p-Orbitale? (eine) (!zwei) (!keine)
Wieviele σ-Bindungen gibt es ingesamt? (!eine) (!zwei) (!vier) (fünf)
Was ist mit s-Orbitalen (das 1s und das 2s) bei den Kohlenstoffatomen? (!Die lassen wir beide weg, weil es zu übersichtlich wird.) (Das 1s-Orbital ist voll und kann deshalb keine Bindung ausbilden.) (!Das 2s-Orbital ist voll und kann deshalb keine Bindung ausbilden.) (Das 2s-Orbital gibt es gar nicht.)
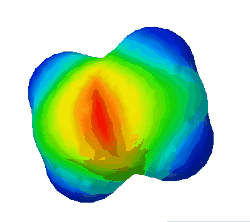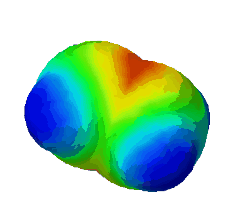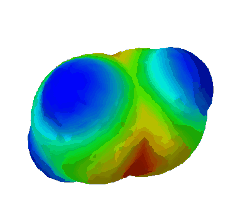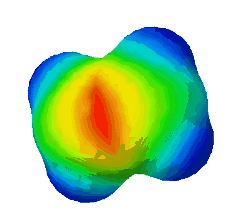
In diesem Bild ist die Elektronendichte bei einem Ethen-Molekül dargestellt. Rot steht für eine hohe Elektronendichte, blau für eine geringe.
Warum sind an zwei Stellen - oben und unten - rote Flecken zu sehen? (Das sind die Elektronen der Pi-Bindung) (!Wegen der Doppelbindung sind dort viele Elektronen.) (!Oben ist die σ-Bindung und unten die π-Bindung.)
Was gilt für alle σ-Bindungen, wie man auch im Bild oben sehen konnte? (!Sie werden immer mit sp³-Orbitalen gebildet.) (!Sie werden nur durch Überlappung von Hybrid-Orbitalen gebildet.) (!Sie sind Rotationssymmetrisch um die Verbindung der Kerne angeordnet.) (!Es ist immer ein s-Orbital beteiligt.)