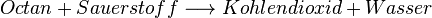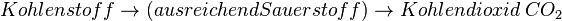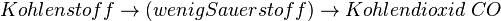Abgase und Katalysator: Unterschied zwischen den Versionen
(→Die optimale Verbrennung) |
|||
| (16 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| + | <metakeywords>ZUM2Edutags,Chemie-digital,Chemie,Katalysator,Abgase,Stöchiometrisches Gemisch,Teilchenmodell,Reaktionsschema,Reaktionsgleichung,Kohlenwasserstoffe,Lambdasone,Kohlenmonoxid,Symbolschreibweise,systematische Benennung</metakeywords> | ||
| + | |||
{{AufgabeNr|1|Lernt die Atomsymbole von dem Arbeitsblatt, auf dem sie eingeführt wurden. Ist müsst sowohl die Symbole zu den Elementen kennenlernen als auch die Elemente zu den Symbolen kennen. In '''den nächsten Stunden''' werden diese immer wieder abgefragt.}} | {{AufgabeNr|1|Lernt die Atomsymbole von dem Arbeitsblatt, auf dem sie eingeführt wurden. Ist müsst sowohl die Symbole zu den Elementen kennenlernen als auch die Elemente zu den Symbolen kennen. In '''den nächsten Stunden''' werden diese immer wieder abgefragt.}} | ||
| Zeile 8: | Zeile 10: | ||
Die dabei stattfindende Reaktion ist die folgende: | Die dabei stattfindende Reaktion ist die folgende: | ||
| − | * <math>Octan + Sauerstoff \ | + | * <math>Octan + Sauerstoff \longrightarrow Kohlendioxid + Wasser</math> |
| − | Aber es geht nicht nur um | + | Aber es geht nicht nur um die Verbrennung an sich - tatsächlich wird diese ja auch als Explosion im Zylinder ausgeführt - denn wie gut die Verbrennung/Explosion abläuft hängt davon ab, ob man die Edukte im richtigen Verhältnis hat. Dazu ein Experiment: |
{{Versuche|In einem kleinen Plastikdöschen befinden sich zwei Elektroden, bei denen mit Hilfe eines sogenannten Piezzo-Zünder ''(in elektrischen Feuerzeugen enthalten)'' ein Funken erzeugt werden kann. | {{Versuche|In einem kleinen Plastikdöschen befinden sich zwei Elektroden, bei denen mit Hilfe eines sogenannten Piezzo-Zünder ''(in elektrischen Feuerzeugen enthalten)'' ein Funken erzeugt werden kann. | ||
| Zeile 21: | Zeile 23: | ||
{{Kurzregel|[[Datei:Teilchenmodell Explosion Stöchiometrisch.png|100px|thumb|Stöchiometrisches Gemisch]] | {{Kurzregel|[[Datei:Teilchenmodell Explosion Stöchiometrisch.png|100px|thumb|Stöchiometrisches Gemisch]] | ||
| − | Liegen die Edukte im richtigen Mengen-Verhältnis vor, so ist die Reaktion besonders stark. Man nennt dies ein '''Stöchiometrisches Gemisch'''. | + | Liegen die Edukte im richtigen Mengen-Verhältnis vor, so ist die Reaktion besonders stark. Man nennt dies ein '''Stöchiometrisches Gemisch'''. |
* '''Stöchiometrisches Gemisch im Teilchenmodell''': Die Anzahl der Teilchen der Edukte ist jeweils so, dass sie im richtigen Verhältnis für eine vollständige Reaktion ist. Es bleibt keines der Edukt-Teilchen übrig (''siehe Bild rechts - klicken zum Vergrößern''). | * '''Stöchiometrisches Gemisch im Teilchenmodell''': Die Anzahl der Teilchen der Edukte ist jeweils so, dass sie im richtigen Verhältnis für eine vollständige Reaktion ist. Es bleibt keines der Edukt-Teilchen übrig (''siehe Bild rechts - klicken zum Vergrößern''). | ||
| − | Hat man zu viel vom Brennstoff, so nennt man das Gemisch zu '''fett''', hat man zu wenig Brennstoff, so nennt man das Gemisch zu '''mager'''.}} | + | Hat man zu viel vom Brennstoff, so nennt man das Gemisch zu '''fett''', hat man zu wenig Brennstoff, so nennt man das Gemisch zu '''mager'''. Eventuell kann dies auch dazu führen, dass die Stoffe nicht miteinander reagieren.}} |
<center>[[File:Explosionsgrenzen.svg|700px]]</center> | <center>[[File:Explosionsgrenzen.svg|700px]]</center> | ||
| Zeile 35: | Zeile 37: | ||
Lambdasonden werden hauptsächlich bei Ottomotoren, aber auch bei der Abgasregelung von Pelletheizungen und Dieselmotoren eingesetzt.|2=Lambdasonde|3=18.7.2013}} | Lambdasonden werden hauptsächlich bei Ottomotoren, aber auch bei der Abgasregelung von Pelletheizungen und Dieselmotoren eingesetzt.|2=Lambdasonde|3=18.7.2013}} | ||
| + | == Welche Abgase gibt es zum Beispiel beim Auto == | ||
| + | |||
| + | Wie im Zitat des Artikels erwähnt, geht es bei der Lamdasonde nicht um nur darum eine vollständige Verbrennung zu ermöglichen, sondern auch darum, das Abgas von schädlichen Anteilen frei zu halten. Diese entstehen bei einer Verbrennung, wenn zu wenig Sauerstoff vorhanden ist. Normalerweise entsteht bei einer Verbrennung von Kohlenstoffhaltigen Brennstoffen immer Kohlenstoffdioxid | ||
| + | * <math>Kohlenstoff \rightarrow (ausreichend Sauerstoff) \rightarrow Kohlendioxid \; CO_2</math> | ||
| + | Ist zu wenig Sauerstoff vorhanden, kann sich kein Kohlen'''di'''oxid bilden sondern nur das giftige Kohlen'''mono'''oxid CO | ||
| + | * <math>Kohlenstoff \rightarrow (wenig Sauerstoff) \rightarrow Kohlendioxid \; CO</math> | ||
| + | Bei der Verbrennung von Wasserstoff passiert so etwas ähnliches nicht. Da wird immer als Verbrennungsprodukt Wasser erzeugt. | ||
| + | |||
| + | {{wpde|Kohlenmonoxid|Kohlenmonoxid}} .... | ||
| + | |||
| + | Neben dem Kohlenmonoxid können beim Auto weitere ungesunde Verbrennungsabgase entstehen, die durch zu wenig Sauerstoff entstehen. Benzin ist ja ein Gemisch verschiedener Kohlenwasserstoffen, aber - trotz Reinigung - sind Verbindungen enthalten, die auch Schwefel und Stickstoff enthalten. Dies kann bei der Verbrennung (also Reaktion mit Sauerstoff) zu weiteren Produkten führen, die mehr oder weniger giftig sind. | ||
| + | * <math>Schwefel \rightarrow (wenig Sauerstoff) \rightarrow Schwefeldioxid\; SO_2</math> | ||
| + | * <math>Schwefel \rightarrow (mehr Sauerstoff) \rightarrow Schwefeltrioxid \; SO_3</math> | ||
| + | * <math>Stickstoff \rightarrow (wenig Sauerstoff} \rightarrow Stickstoffmonooxid \; NO</math> | ||
| + | |||
| + | Da die Anzahl der Sauerstoffatome im Molekül eine Rolle spielt, werden wir uns damit noch einmal kurz beschäftigen und die Benennung von Verbindungen aufgrund ihrer Formel üben: | ||
| + | |||
| + | {{Kurzregel| | ||
| + | * Verbindungen haben oft zusammengesetzte Teilchen (die '''Moleküle'''), die aus mehreren Atomen bestehen. | ||
| + | * Man kann die genaue Zusammensetzung mit Hilfe einer Zeichnung verdeutlichen: | ||
| + | <center>[[Datei:Beispiele Verbindungen im Kugel-Teilchen-Modell.png|500px]]</center> | ||
| + | ... wobei als Farben meistens verwendet werden. | ||
| + | <center>[[Datei:Farben für Teilchenmodellkugeln.png|550px]]</center> | ||
| + | * In der Chemie üblich ist die '''Symbolschreibweise''', bei der man für die Atome spezielle Buchstaben (die Atomsymbole) verwendet. Man bezeichnet die Schreibweise auch als '''Formel''' eines Stoffes: | ||
| + | ** <u>Wasser:</u> H<sub>2</sub>O | ||
| + | ** <u>Stickoxid:</u> NO | ||
| + | ** <u>Ammoniak:</u> NH<sub>3</sub> | ||
| + | * Neben den geläufigen Namen ('''Trivialnamen''') hat jede Verbindung immer einen '''systematischen''', der sich aus der Formel ergibt: | ||
| + | ** <u>Wasser:</u> Diwasserstoffoxid | ||
| + | ** <u>Stickoxid:</u> Stickstoffmonooxid | ||
| + | ** <u>Ammoniak:</u> Stickstofftrihydrid | ||
| + | }} | ||
| + | |||
| + | {{Kurzregel|Die '''Vorsilben''' für die Angabe der '''Anzahlen''' in den '''Systematischen Namen''' sind: Mono-, Di-, Tri-, Tetra-, Penta-, Hexa-, Hepta-, Okta-, Nona-}} | ||
| + | |||
| + | {{Kurzregel|1=Die Endungen ergeben sich aus den hinten stehenden Elementen. Meist wird der lateinische/englische Name verwendet. Merke dir: | ||
| + | * ...O = '''-oxid''' | ||
| + | * ...H = '''-hydrid''' | ||
| + | * ...S = '''-sulfid''' | ||
| + | * ...Cl = '''-chlorid''' | ||
| + | * ...N = '''-nitrid''' | ||
| + | * ...Br = '''-bromid'''}} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|2|Bei der Verbrennung von Stickstoff kann eine Vierzahl an Verbindungen entstehen. Die Stickoxide - ''die man auch mit NO<sub>x</sub> beschreibt'' - können genau mit dem systematischen Namen benannt werden. | ||
| + | |||
| + | '''1.) Schreibe aus dem Artikel {{wpde|Stickstoffoxide|Stickstoffoxide}} die Formeln aller Stickoxid aus der ersten Tabelle heraus und bestimme ihren systematischen Namen unter Verwendung der Vorsilben.''' | ||
| + | :''<u>ACHTUNG:</u> Im Artikel (in der Tabelle) selber werden zur Benennung teilweise '''Trivialnamen''' verwendet. Versuche zu erkennen, welcher Name systematisch ist und welcher nicht.'' | ||
| + | |||
| + | '''2.) Lerne die Vorsilben und die Endungen auswendig.''' | ||
| + | :''<u>Tipp:</u> Versuche dich an der Verwendung dieser Vorsilbe in anderen Zusammenhängen zu erinnern ... Monorail, Trimaran, Tetraeder, Pentagon/Pentagramm, Oktober, ....'' }} | ||
| + | |||
| + | So, nun können wir also verschiedene Oxide leicht anhand ihres systematischen Namens unterscheiden. Warum ist es aber so wichtig, auf die Verbrennungsprodukte zu achten? | ||
| + | * '''Kohlendioxid CO<sub>2</sub>''' kommt natürlich in der Atmosphäre vor. In hohen Konzentrationen wirkt es zwar erstickend, aber vor allem deshalb weil dann ein Mangel an Sauerstoff herrscht und es sich durch die höhere Dichte am Boden sammeln kann. | ||
| + | * '''Kohlenstoffmonoxid CO''' ist ein gefährliches Atemgift. Wenn es über die Lunge in den Blutkreislauf gelangt ist, bindet es sich fest an das Hämoglobins der roten Blutkörperchen und behindert so den Sauerstofftransport im Blut, was zum Tod durch Erstickung führen kann. | ||
| + | |||
| + | |||
| + | * '''Stickstoffmonoxid NO''' ist ein farbloses und giftiges Gas. An der Luft wirkt Stickstoffmonoxid schleimhautreizend und die Giftwirkung geschieht durch Bindung an das Hämoglobin. | ||
| + | * '''Stickstoffdioxid NO<sub>2</sub>''' ist ein rotbraunes, giftiges, stechend chlorähnlich riechendes Gas. In Wasser gelöst bildet sich Salpetersäure, die mit zum sauren Regen beträgt. | ||
| + | * '''Stickstoff N<sub>2</sub>''' wirkt zwar in hohen Konzetrationen auch erstickend, verhält sich aber neutral. Schließlich besteht der größte Teil der Luft aus Stickstoff. | ||
| + | |||
| + | |||
| + | * '''Schwefeldioxid SO<sub>2</sub>''' ist ein farbloses, schleimhautreizendes, stechend riechendes und sauer schmeckendes, giftiges Gas. In Wasser gelöst bildet es die Schweflige Säure, die den wesentlichen Anteil des „Saurem Regens“ ausmacht, der empfindliche Ökosysteme wie Wald und Seen gefährdet, Gebäude und Materialien angreift. | ||
| + | |||
| + | === Lösungen von Nichtmetalloxiden === | ||
| + | |||
| + | {{Versuche|}} | ||
| + | |||
| + | == Die Bedeutung und Wirkung des Katalysators == | ||
| + | [[File:Pot catalytique vue de la structure.jpg|right|300px]] | ||
| + | Bei einer Geschwindigkeit von 130 km/h entstehen in einem normaler Otto-Motor entstehen pro Minute etwa 2 m<sup>3</sup> Abgas. Etwa 2 % davon sind Kohlenmonoxid, Stickoxid und unverbranntes Benzin. Im Katalysator, der in das Auspuffrohr eingebaut ist, wird an den, mit speziellen Metallen beschichteten Keramikwaben, verhindert, dass vor allem die schädlichen Abgase in die Umwelt abgegeben werden. Nur beim Schwefel ist es nicht möglich, die Entstehung von Schwefeldioxid zu verhindern. Deshalb muss das Benzin möglichst schwefelarm sein. | ||
| + | Um zu verstehen, was in einem Katalysator geschieht, wollen wir einige Reaktionen betrachten, die ablaufen. Dabei unterscheiden wir zwischen ... | ||
| + | {{Kurzregel| | ||
| + | *'''Reaktionsschema:''' Die Edukte und Produkte werden jeweils mit ihrem Namen (''Trivialname oder systematischer Name'') genannt. | ||
| + | * '''Reaktionsgleichung:''' Die Edukte und Produkte werden durch ihre Moleküle/Atome repräsentiert bzw. deren '''Symbolschreibweise'''. Außerdem muss die '''Anzahl der beteiligten Atome bei den Edukten und Produkten identisch''' sein, denn nach dem '''Gesetz von der Erhaltung der Masse''' darf ja nichts verloren gehen. Deswegen muss man angeben, '''wieviele Atome/Moleküle''' reagieren. | ||
| + | *Die Verwendung von Plus (+) und Reaktionspfeil (→) ist die gleiche. | ||
| + | }} | ||
| + | {{AufgabeNr|3|Wir betrachten die Funktion des Katalysators im Teilchenmodell genauer. Bearbeite dazu das Arbeitsblatt hier.}} | ||
| − | + | Nun kennt ihr ja schon den Begriff Katalysator ja schon von der Enegriebetrachtung bei chemischen Reaktionen. Die Definition war ja: | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | {{Kurzregel|Ein '''Katalysator''' verringert die Aktivierungsenergie bei exothermen Reaktionen. Er nimmt zwar an der Reaktion teil, wird aber nicht verbraucht.}} | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| + | Der Name des Autokatalysators hat deshalb damit zu tun, dass die darin ablaufenden Reaktionen auch bei niedrigeren Temperaturen ablaufen als ohne Katalysator. Es gibt weitere, spezielle Katalysatoren. | ||
| + | :''Mehr Details zum Autokatalysator können Interessierte im Wikipedia-Artikel {{wpde|Fahrzeugkatalysator|Fahrzeugkatalysator}} nachlesen. Allgemeinere Informationen über die chemischen Hintergründe gibt es im Artikel {{wpde|Katalysator|Katalysator}}.'' | ||
| − | + | [[Kategorie:Chemische Reaktionen]][[Kategorie:Reaktionen mit Sauerstoff]][[Kategorie:Energie]][[Kategorie:Symbolschreibweise]][[Kategorie:Teilchenmodell]] | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
Aktuelle Version vom 14. Januar 2014, 15:57 Uhr
30px Aufgabe 1
Lernt die Atomsymbole von dem Arbeitsblatt, auf dem sie eingeführt wurden. Ist müsst sowohl die Symbole zu den Elementen kennenlernen als auch die Elemente zu den Symbolen kennen. In den nächsten Stunden werden diese immer wieder abgefragt. |
Inhaltsverzeichnis |
Die optimale Verbrennung
Im Benzin-Motor im Auto wird zum Beispiel Octan verbrannt, dass die Formel C8H18 hat. Es ist ein Kohlenwasserstoff und daher sind die Verbrennungsgase üblicherweise:
- Kohlen(stoff)dioxid CO2
- Wasser H2O
Die dabei stattfindende Reaktion ist die folgende:
Aber es geht nicht nur um die Verbrennung an sich - tatsächlich wird diese ja auch als Explosion im Zylinder ausgeführt - denn wie gut die Verbrennung/Explosion abläuft hängt davon ab, ob man die Edukte im richtigen Verhältnis hat. Dazu ein Experiment:
| VERSUCH:
In einem kleinen Plastikdöschen befinden sich zwei Elektroden, bei denen mit Hilfe eines sogenannten Piezzo-Zünder (in elektrischen Feuerzeugen enthalten) ein Funken erzeugt werden kann. Man gibt in das Döschen Tropfen eines Kohlenwasserstoffs, schüttelt das Döschen um den Kohlenwasserstoff zu verteilen und entzündet das Gas-Luft-Gemisch. Wie verhält sich das Gemisch bei verschiedenen Kohlenwasserstoff-Konzentration? Wenn mal sehr viel oder sehr wenig drin ist. |
|
Liegen die Edukte im richtigen Mengen-Verhältnis vor, so ist die Reaktion besonders stark. Man nennt dies ein Stöchiometrisches Gemisch.
Hat man zu viel vom Brennstoff, so nennt man das Gemisch zu fett, hat man zu wenig Brennstoff, so nennt man das Gemisch zu mager. Eventuell kann dies auch dazu führen, dass die Stoffe nicht miteinander reagieren. |
Damit die Verbrennung im Auto-Motor optimal ist gibt es die sogenannte 19px Lambdasonde .
| Die Lambdasonde (λ-Sonde) ist ein Sensor, der in einem Verbrennungsabgas den jeweiligen Restsauerstoffgehalt misst, um daraus das Verhältnis von Verbrennungsluft zu Kraftstoff einstellen zu können. Der Zweck dieser Regelung besteht nicht unbedingt darin, das Verhältnis von Verbrennungsluft und Kraftstoff auf einen vollständigen Verbrauch von Sauerstoff aus der Verbrennungsluft und Kraftstoff einzustellen (λ=1). Vielmehr wird versucht, die Stickoxide und Ruß zu minimieren. Die Lambdasonde ist der Hauptsensor im Regelkreis der Lambdaregelung zur katalytischen Abgasreinigung (umgangssprachlich: geregelter Katalysator). ...
Lambdasonden werden hauptsächlich bei Ottomotoren, aber auch bei der Abgasregelung von Pelletheizungen und Dieselmotoren eingesetzt. 16px Lambdasonde, Wikipedia – Die freie Enzyklopädie, 18.7.2013 - Der Text ist unter der Lizenz „Creative Commons Attribution/Share Alike“ verfügbar; zusätzliche Bedingungen können anwendbar sein. Siehe die Nutzungsbedingungen für Einzelheiten. In der Wikipedia ist eine Liste der Autoren verfügbar. |
Welche Abgase gibt es zum Beispiel beim Auto
Wie im Zitat des Artikels erwähnt, geht es bei der Lamdasonde nicht um nur darum eine vollständige Verbrennung zu ermöglichen, sondern auch darum, das Abgas von schädlichen Anteilen frei zu halten. Diese entstehen bei einer Verbrennung, wenn zu wenig Sauerstoff vorhanden ist. Normalerweise entsteht bei einer Verbrennung von Kohlenstoffhaltigen Brennstoffen immer Kohlenstoffdioxid
Ist zu wenig Sauerstoff vorhanden, kann sich kein Kohlendioxid bilden sondern nur das giftige Kohlenmonooxid CO
Bei der Verbrennung von Wasserstoff passiert so etwas ähnliches nicht. Da wird immer als Verbrennungsprodukt Wasser erzeugt.
19px Kohlenmonoxid ....
Neben dem Kohlenmonoxid können beim Auto weitere ungesunde Verbrennungsabgase entstehen, die durch zu wenig Sauerstoff entstehen. Benzin ist ja ein Gemisch verschiedener Kohlenwasserstoffen, aber - trotz Reinigung - sind Verbindungen enthalten, die auch Schwefel und Stickstoff enthalten. Dies kann bei der Verbrennung (also Reaktion mit Sauerstoff) zu weiteren Produkten führen, die mehr oder weniger giftig sind.
-
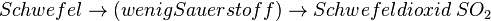
-
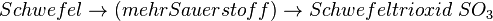
- Fehler beim Parsen(Syntaxfehler): Stickstoff \rightarrow (wenig Sauerstoff} \rightarrow Stickstoffmonooxid \; NO
Da die Anzahl der Sauerstoffatome im Molekül eine Rolle spielt, werden wir uns damit noch einmal kurz beschäftigen und die Benennung von Verbindungen aufgrund ihrer Formel üben:
| Die Vorsilben für die Angabe der Anzahlen in den Systematischen Namen sind: Mono-, Di-, Tri-, Tetra-, Penta-, Hexa-, Hepta-, Okta-, Nona- |
Die Endungen ergeben sich aus den hinten stehenden Elementen. Meist wird der lateinische/englische Name verwendet. Merke dir:
|
30px Aufgabe 2
Bei der Verbrennung von Stickstoff kann eine Vierzahl an Verbindungen entstehen. Die Stickoxide - die man auch mit NOx beschreibt - können genau mit dem systematischen Namen benannt werden. 1.) Schreibe aus dem Artikel 19px Stickstoffoxide die Formeln aller Stickoxid aus der ersten Tabelle heraus und bestimme ihren systematischen Namen unter Verwendung der Vorsilben.
2.) Lerne die Vorsilben und die Endungen auswendig.
|
So, nun können wir also verschiedene Oxide leicht anhand ihres systematischen Namens unterscheiden. Warum ist es aber so wichtig, auf die Verbrennungsprodukte zu achten?
- Kohlendioxid CO2 kommt natürlich in der Atmosphäre vor. In hohen Konzentrationen wirkt es zwar erstickend, aber vor allem deshalb weil dann ein Mangel an Sauerstoff herrscht und es sich durch die höhere Dichte am Boden sammeln kann.
- Kohlenstoffmonoxid CO ist ein gefährliches Atemgift. Wenn es über die Lunge in den Blutkreislauf gelangt ist, bindet es sich fest an das Hämoglobins der roten Blutkörperchen und behindert so den Sauerstofftransport im Blut, was zum Tod durch Erstickung führen kann.
- Stickstoffmonoxid NO ist ein farbloses und giftiges Gas. An der Luft wirkt Stickstoffmonoxid schleimhautreizend und die Giftwirkung geschieht durch Bindung an das Hämoglobin.
- Stickstoffdioxid NO2 ist ein rotbraunes, giftiges, stechend chlorähnlich riechendes Gas. In Wasser gelöst bildet sich Salpetersäure, die mit zum sauren Regen beträgt.
- Stickstoff N2 wirkt zwar in hohen Konzetrationen auch erstickend, verhält sich aber neutral. Schließlich besteht der größte Teil der Luft aus Stickstoff.
- Schwefeldioxid SO2 ist ein farbloses, schleimhautreizendes, stechend riechendes und sauer schmeckendes, giftiges Gas. In Wasser gelöst bildet es die Schweflige Säure, die den wesentlichen Anteil des „Saurem Regens“ ausmacht, der empfindliche Ökosysteme wie Wald und Seen gefährdet, Gebäude und Materialien angreift.
Lösungen von Nichtmetalloxiden
| VERSUCH: |
Die Bedeutung und Wirkung des Katalysators
Bei einer Geschwindigkeit von 130 km/h entstehen in einem normaler Otto-Motor entstehen pro Minute etwa 2 m3 Abgas. Etwa 2 % davon sind Kohlenmonoxid, Stickoxid und unverbranntes Benzin. Im Katalysator, der in das Auspuffrohr eingebaut ist, wird an den, mit speziellen Metallen beschichteten Keramikwaben, verhindert, dass vor allem die schädlichen Abgase in die Umwelt abgegeben werden. Nur beim Schwefel ist es nicht möglich, die Entstehung von Schwefeldioxid zu verhindern. Deshalb muss das Benzin möglichst schwefelarm sein.
Um zu verstehen, was in einem Katalysator geschieht, wollen wir einige Reaktionen betrachten, die ablaufen. Dabei unterscheiden wir zwischen ...
|
30px Aufgabe 3
Wir betrachten die Funktion des Katalysators im Teilchenmodell genauer. Bearbeite dazu das Arbeitsblatt hier. |
Nun kennt ihr ja schon den Begriff Katalysator ja schon von der Enegriebetrachtung bei chemischen Reaktionen. Die Definition war ja:
| Ein Katalysator verringert die Aktivierungsenergie bei exothermen Reaktionen. Er nimmt zwar an der Reaktion teil, wird aber nicht verbraucht. |
Der Name des Autokatalysators hat deshalb damit zu tun, dass die darin ablaufenden Reaktionen auch bei niedrigeren Temperaturen ablaufen als ohne Katalysator. Es gibt weitere, spezielle Katalysatoren.
- Mehr Details zum Autokatalysator können Interessierte im Wikipedia-Artikel 19px Fahrzeugkatalysator nachlesen. Allgemeinere Informationen über die chemischen Hintergründe gibt es im Artikel 19px Katalysator .