Multiple-Choice-Tests zu Redoxreaktion(1): Unterschied zwischen den Versionen
| Zeile 82: | Zeile 82: | ||
'''Falls du zu viele Fehler hattest, solltest du, wie in der Aufgabe gefordert, mal den den Reaktionen jeweils alles ausführlich aufschreiben. Probiere dann noch mal, die Fragen zu beantworten!''' | '''Falls du zu viele Fehler hattest, solltest du, wie in der Aufgabe gefordert, mal den den Reaktionen jeweils alles ausführlich aufschreiben. Probiere dann noch mal, die Fragen zu beantworten!''' | ||
| − | [[Kategorie:MC-Test]][[Kategorie:Quiz]] | + | [[Kategorie:MC-Test]][[Kategorie:Quiz]][[Kategorie:Redoxreaktionen]] |
Aktuelle Version vom 5. Februar 2014, 21:03 Uhr
Aufgabe: Schreibe dir jeweils die Reaktionsgleichung mit Überschrift ins Heft ab und trage, wie in der Schule, folgendes ein:
- Die Teilreaktionen durch Pfeile unter der Gesamtreaktion.
- Auf die Pfeile die Art der Reaktion und ob sie exotherm oder endotherm ist.
- Welches der Edukte ist das Reduktionsmittel und was das Reduktionsmittel?
Beantworte dann die Fragen des jeweiligen Multiple-Choice-Tests. Zeige die fertigen Reaktionsschemata vor bzw. vergleiche sie mit der Lösung.
Hinweis: Die Reaktionsgleichung dient nur der Information, welche Stoffe und Elemente beteiligt sind. Für die Aufgaben soll jeweils das Reaktionsschema verwendet werden.
|
1.) Reaktion von Magnesium mit Wasser Die Löschversuche mit Wasser führen dazu, dass das Feuer noch mehr auflammt. Also muss das Magnesium mit dem Wasser reagieren. Das Reaktionsschema lautet: 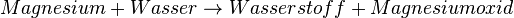 Reaktionsgleichung: 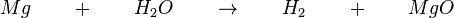 Dazu nun ein paar Fragen. Eine Zwischenkontrolle ist unpraktisch, da dir dann schon die nächsten Antworten vorgegeben werden. Falls du eine richtige Antwort nicht verstehst, halte betreffende Frage mit Heft mit der richtigen Antwort ebenfalls fest und notiere dir deine Frage dazu. Was müsste zu beobachten sein, wenn das Wasser nicht mit dem brennenden Magnesium reagiert? (Die Reaktion sollte nicht stärker werden.) (Das brennende Magnesium kann durch das Wasser gelöscht werden.) Wenn man nicht-brennendes Magnesium mit Wasser zusammenbringt findet keine Reaktion statt. Welche Bedeutung hat vermutlich die Wärme des "Feuers"? (Sie dient als Aktivierungsenergie.) (!Sie bringt das Wasser zum Verdampfen.) Was brennt da so hell, wenn man Wasser dazuspritzt? (!Wasser) (!Magnesium) (Wasserstoff)
Welche der Teilreaktionen, in der oben angegebenen Reaktion, ist exotherm? (Magnesium → Magnesiumoxid) (!Wasser → Wasserstoff) (!Magnesium → Wasser) Welche der Teilreaktionen, in der oben angegebenen Reaktion, ist endotherm? (!Magnesium → Magnesiumoxid) (Wasser → Wasserstoff) (!Wasser → Magnesiumoxid) Was gibt mehr Energie bei der Reaktion mit Sauerstoff ab? (!Wasserstoff) (Magnesium) | ||
| | ||
|
Noch besseres Video dazu, wo auch die Reaktionsprodukte gezeigt werden. Allerdings nicht überall lauffähig! |
2.) Reaktion von Magnesium mit Trockeneis
Trockeneis ist gefrorenes Kohlendioxid (Temperatur unter 78 °C). Eigentlich erstickt Kohlendioxid sonst Flammen. Trotzdem verstärkt das gefrorene Kohlendioxid die Verbrennung von Magnesium. Auch hier findet wieder eine Reaktion zwischen dem Magnesium und dem Kohlendioxid statt, die stärker als die Verbrennung von Magnesium an der Luft ist. Die Reaktionsschema lautet: 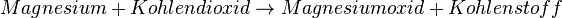 Reaktionsgleichung: 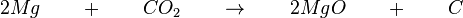 Nun wieder ein paar Fragen dazu: Warum verstärkt sich die Reaktion von Magnesium zu Magnesiumoxid? (!Das Kohlendioxid liefert Aktivierungsenergie) (Das Kohlendioxid liefert Sauerstoff) Warum würde das kalte, nicht-brennende Magnesium nicht reagieren? Was fehlt? (Die Aktivierungsenergie) (!Der Sauerstoff) Was liefert die Energie für die Zerlegung des Kohlendioxids? (!Das Trockeneis) (Die Verbrennung des Magnesiums) (!Die Hitze der Bunsenbrenner-Flamme) Warum würden Eisenspäne, die man im Trockeneis entzündet, nicht weiterbrennen? (Die Oxidation des Eisens liefert nicht genügend Energie zur Zerlegung des Kohlendixoids) (Das Kohlendioxid würde das Feuer ersticken) (!Eisen braucht für eine Oxidation mehr Aktivierungsenergie so dass das Trockeneis es verhindert.) |
Falls du zu viele Fehler hattest, solltest du, wie in der Aufgabe gefordert, mal den den Reaktionen jeweils alles ausführlich aufschreiben. Probiere dann noch mal, die Fragen zu beantworten!

