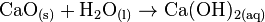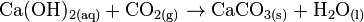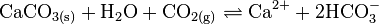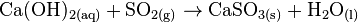Kalkwasserprobe: Unterschied zwischen den Versionen
(→Theorie dazu) |
(+Kategorie:Analyse; +Kategorie:Kohlendioxid using HotCat) |
||
| (Eine dazwischenliegende Version von einem Benutzer wird nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| + | |||
| + | {{#widget:YouTube|id=wpoTzniSL94}} | ||
== Theorie dazu == | == Theorie dazu == | ||
| Zeile 22: | Zeile 24: | ||
Dieser Niederschlag wird an der Luft langsam zu Calciumsulfat oxidiert. | Dieser Niederschlag wird an der Luft langsam zu Calciumsulfat oxidiert. | ||
| + | |||
| + | [[Kategorie:Analyse]] | ||
| + | [[Kategorie:Kohlendioxid]] | ||
Aktuelle Version vom 17. Mai 2015, 10:26 Uhr
Theorie dazu
Löst man Calciumoxid in Wasser, entsteht Kalkwasser Ca(OH)2(aq):
Beim Einleiten von Kohlenstoffdioxid trübt sich die Lösung durch Bildung von Calciumcarbonat. Als Nebenprodukt der Reaktion entsteht Wasser.
Die Reaktion lässt sich auch beobachten, wenn Kalkwasser längere Zeit in einem unverschlossenen Gefäß aufbewahrt wird. Die Flüssigkeit entzieht dann der Luft CO2 und trübt sich. Bei längerem Durchleiten von CO2 kann sich das Calciumcarbonat unter Bildung von löslichem Calciumhydrogencarbonat auch wieder auflösen:
Beim Erhitzen der Lösung fällt dann in Umkehrung der Reaktion wieder Calciumcarbonat aus.
ACHTUNG: Schwefeldioxid bildet mit Kalkwasser ebenfalls einen weißen Niederschlag von Calciumsulfit:
Dieser Niederschlag wird an der Luft langsam zu Calciumsulfat oxidiert.