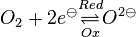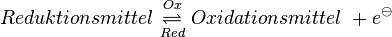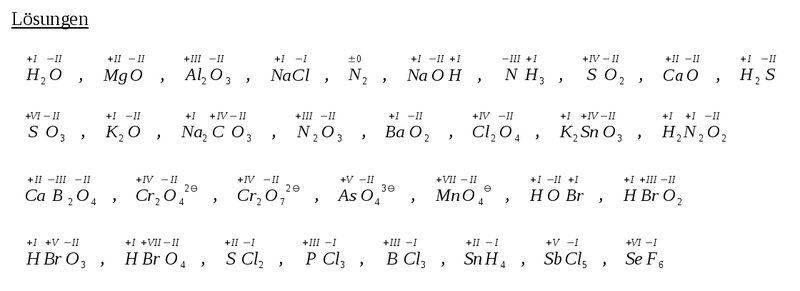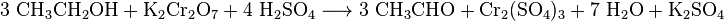Gewinnung von Brom am Toten Meer: Unterschied zwischen den Versionen
(→Experimente zu den Halogenen) |
(→Bestimmung der Oxidationszahl bei einfachen Verbindungen) |
||
| (12 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 2: | Zeile 2: | ||
[[File:Brom amp.jpg|thumb|Ampulle mit Brom und Bromdampf]] Wer Brom einmal gesehen hat, wird es vermutlich nicht mehr vergessen: | [[File:Brom amp.jpg|thumb|Ampulle mit Brom und Bromdampf]] Wer Brom einmal gesehen hat, wird es vermutlich nicht mehr vergessen: | ||
| − | Über einer dunklen, rotbraunen Flüssigkeit wabert ein schwerer rotbrauner Dampf, der sich im Raum verteilt. Seinen Namen verdankt Brom dem griechischen Begriff für Gestank (''= brômos''), den Brom zurecht hat, denn Bromdampf hat einen intensiven, chlorähnliches Geruch, den man schon in kleinsten Mengen wahrnehmen kann. Den sollte man sich aber nicht zu häufig antun, denn Brom ist giftiger als Chlor. Deshalb ist | + | Über einer dunklen, rotbraunen Flüssigkeit wabert ein schwerer, rotbrauner Dampf, der sich im Raum verteilt. Seinen Namen verdankt Brom dem griechischen Begriff für Gestank (''= brômos''), den Brom zurecht hat, denn Bromdampf hat einen intensiven, chlorähnliches Geruch, den man schon in kleinsten Mengen wahrnehmen kann. Den sollte man sich aber nicht zu häufig antun, denn Brom ist giftiger als Chlor. Deshalb ist elementares Brom in den Schulen (zumindest in Schülerversuchen) verboten, zumal eine umgeworfene und ausgekippte Flasche Brom meist zur Evakuierung der gesamte Schule führt ([https://www.youtube.com/watch?v=AQHpmg_GvTY Feuerwehr-Bericht als Beispiel]) |
Trotz seiner unangenehmen Eigenschaften gibt es zahlreiche Einsatzgebiete für das "Teufelszeug", von denen hier nur eine kleine Auswahl genannt wird. Eine ausführlichere und genauer Liste liefert der Wikipedia-Artikel {{wpde|https://de.wikipedia.org/wiki/Brom#Verwendung|Brom}}: | Trotz seiner unangenehmen Eigenschaften gibt es zahlreiche Einsatzgebiete für das "Teufelszeug", von denen hier nur eine kleine Auswahl genannt wird. Eine ausführlichere und genauer Liste liefert der Wikipedia-Artikel {{wpde|https://de.wikipedia.org/wiki/Brom#Verwendung|Brom}}: | ||
| − | * es gibt organische Bromverbindungen die als Flammschutzmittel dienen | + | * es gibt organische Bromverbindungen, die als Flammschutzmittel dienen |
* früher gab es zahlreiche Medikamente, die Brom bzw. Bromide enthielten, heute gibt es besseren Ersatz | * früher gab es zahlreiche Medikamente, die Brom bzw. Bromide enthielten, heute gibt es besseren Ersatz | ||
* für die Fotoindustrie wird Silberbromid als lichtempfindliche Suspension verwendet, die auf Fotoplatten verwendet wird | * für die Fotoindustrie wird Silberbromid als lichtempfindliche Suspension verwendet, die auf Fotoplatten verwendet wird | ||
| Zeile 78: | Zeile 78: | ||
=== Der Prozeß zur Gewinnung von Brom === | === Der Prozeß zur Gewinnung von Brom === | ||
| − | Hinter der Gewinnung von Brom aus einer Bromid-Lösung steckt im wesentlichen die Reaktion, die im folgenden Film gezeigt wird | + | Hinter der Gewinnung von Brom aus einer Bromid-Lösung steckt im wesentlichen die Reaktion, die im folgenden Film gezeigt wird. |
| − | <center><iframe | + | <center><iframe src="https://h5p.org/h5p/embed/141411" width="545" height="400" frameborder="0" allowfullscreen="allowfullscreen"></iframe></center> |
| − | + | ||
Die Rotfärbung der Flüssigkeit zeigt, dass Brom entstanden ist, das sich gleich im Wasser gelöst hat. Im Labormaßstab geht die Gewinnung von elementaren Brom also recht einfach, indem man Chlorgas in die Bromidsalzlösung einleitet. Damit sich der Aufwand für eine industrielle Gewinnung - auch unter Beachtung der Sicherheitsmaßnahmen - lohnt, musste ein Verfahren entwickelt werden, in dem kontinuierlich und ohne Unterbrechung der Produktionsprozess stattfinden kann. Das folgende Bild zeigt den Ablauf mit seinen einzelnen Stationen. | Die Rotfärbung der Flüssigkeit zeigt, dass Brom entstanden ist, das sich gleich im Wasser gelöst hat. Im Labormaßstab geht die Gewinnung von elementaren Brom also recht einfach, indem man Chlorgas in die Bromidsalzlösung einleitet. Damit sich der Aufwand für eine industrielle Gewinnung - auch unter Beachtung der Sicherheitsmaßnahmen - lohnt, musste ein Verfahren entwickelt werden, in dem kontinuierlich und ohne Unterbrechung der Produktionsprozess stattfinden kann. Das folgende Bild zeigt den Ablauf mit seinen einzelnen Stationen. | ||
| Zeile 97: | Zeile 96: | ||
Die Ausbeute in der Produktion kann verbessert werden, wenn das meist etwas alkalische Meerwasser mit Hilfe von Schwefelsäure angesäuert wird. Ansonsten würden elementares Brom und Chlor mit dem Wasser reagieren und zunächst Bromwasserstoff bzw. Chlorwasserstoff (=Salzsäuregas) bilden, die den pH-Wert neutralisieren. Dabei wird aber auch die Ausbeute an Brom verringert. | Die Ausbeute in der Produktion kann verbessert werden, wenn das meist etwas alkalische Meerwasser mit Hilfe von Schwefelsäure angesäuert wird. Ansonsten würden elementares Brom und Chlor mit dem Wasser reagieren und zunächst Bromwasserstoff bzw. Chlorwasserstoff (=Salzsäuregas) bilden, die den pH-Wert neutralisieren. Dabei wird aber auch die Ausbeute an Brom verringert. | ||
| − | |||
=== Redoxreaktionen am Beispiel der Bromgewinnung === | === Redoxreaktionen am Beispiel der Bromgewinnung === | ||
| Zeile 123: | Zeile 121: | ||
}} | }} | ||
| − | {{AufgabeNr|2|Halte die Reaktion, die bei der Gewinnung von Brom stattfindet fest und bestimme die Oxidation und Reduktion, sowie das Oxidations- und das Reduktionsmittel. | + | {{AufgabeNr|2|Halte die Reaktion, die bei der Gewinnung von Brom stattfindet, fest und bestimme die Oxidation und Reduktion, sowie das Oxidations- und das Reduktionsmittel. |
<popup name="Anleitung und Lösung"> | <popup name="Anleitung und Lösung"> | ||
Video und Lösung ... ''kommen noch, sorry!'' | Video und Lösung ... ''kommen noch, sorry!'' | ||
| Zeile 140: | Zeile 138: | ||
:<math>Na \underset{Red} {\overset{Ox} \rightleftharpoons} Na ^{ \oplus} + e^{ \ominus}</math> und <math>O_2 + 2 e^{ \ominus} \underset{Ox} {\overset{Red} \rightleftharpoons} O ^{2 \ominus} </math> | :<math>Na \underset{Red} {\overset{Ox} \rightleftharpoons} Na ^{ \oplus} + e^{ \ominus}</math> und <math>O_2 + 2 e^{ \ominus} \underset{Ox} {\overset{Red} \rightleftharpoons} O ^{2 \ominus} </math> | ||
Allgemein kann man es so formulieren ''(wobei Ladungen der Ionen nicht angegeben sind)'': | Allgemein kann man es so formulieren ''(wobei Ladungen der Ionen nicht angegeben sind)'': | ||
| − | :<math> | + | :<math>Reduktionsmittel \ \underset{Red} {\overset{Ox} \rightleftharpoons} \ Oxidationsmittel \ + e^{ \ominus}</math> |
}} | }} | ||
| Zeile 158: | Zeile 156: | ||
{{AufgabeNr|4 - Wiederholung: Benennung von wichtigen Ionen und Ionenverbindungen|2= | {{AufgabeNr|4 - Wiederholung: Benennung von wichtigen Ionen und Ionenverbindungen|2= | ||
Da wir uns gleich einige der wichtigen und häufig verwendeten mehratomigen Ionen anschauen, wiederholen wir an der Stelle noch einmal einige Namen dieser Ionen und auch wie man Ionenverbindungen benennt und die Formel angibt. | Da wir uns gleich einige der wichtigen und häufig verwendeten mehratomigen Ionen anschauen, wiederholen wir an der Stelle noch einmal einige Namen dieser Ionen und auch wie man Ionenverbindungen benennt und die Formel angibt. | ||
| − | * Arbeitsblatt: [http://wikis.zum.de/chemie-digital/Datei:ARBEITSBLATT_Ionen,_S%C3%A4uren,_Ladungen,_Namen.pdf Namen der wichtigsten | + | * Arbeitsblatt: [http://wikis.zum.de/chemie-digital/Datei:ARBEITSBLATT_Ionen,_S%C3%A4uren,_Ladungen,_Namen.pdf Namen der wichtigsten Ionen] |
* Arbeitsblatt: Benennung und Formel von Ionenverbindungen | * Arbeitsblatt: Benennung und Formel von Ionenverbindungen | ||
}} | }} | ||
| Zeile 179: | Zeile 177: | ||
|- | |- | ||
| 3 || '''Die Summe aller Oxidationszahlen in einer Verbindung/einem Molekül entspricht der Ladung''' | | 3 || '''Die Summe aller Oxidationszahlen in einer Verbindung/einem Molekül entspricht der Ladung''' | ||
| − | || Die Gesamt- | + | || Die Gesamt-Ladung (e<sup>-</sup> und p<sup>+</sup>) muss stimmen. Das kann bei einer neutralen Verbindung zusammen Null sein, bei einem geladenen Molekül ist es dessen Ladung. |
||CH<sub>4</sub> <br />→ C -IV und H je +I also -4 + 4*(+1) = 0<br />SO<sub>4</sub><sup>2-</sup><br />→ S + VI und O -II also +6 + 4*(-2) = -2 | ||CH<sub>4</sub> <br />→ C -IV und H je +I also -4 + 4*(+1) = 0<br />SO<sub>4</sub><sup>2-</sup><br />→ S + VI und O -II also +6 + 4*(-2) = -2 | ||
|- | |- | ||
| Zeile 207: | Zeile 205: | ||
{{AufgabeNr|5 - Bestimmung der Oxidationszahlen in anorganischen Verbindungen und Molekül-Ionen|2= | {{AufgabeNr|5 - Bestimmung der Oxidationszahlen in anorganischen Verbindungen und Molekül-Ionen|2= | ||
| − | ''Hier gibt es zum Austoben ein paar Aufgaben'' ... Bestimmt die | + | ''Hier gibt es zum Austoben ein paar Aufgaben'' ... Bestimmt die Oxidationszahlen in den folgenden Verbindungen: |
:H<sub>2</sub>O, MgO, Al<sub>2</sub>O<sub>3</sub>, NaCl, N<sub>2</sub>, NaOH, NH<sub>3</sub>, SO<sub>2</sub>, CaO, H<sub>2</sub>S, SO<sub>3</sub>, K<sub>2</sub>O, Na<sub>2</sub>CO<sub>3</sub> , N<sub>2</sub>O<sub>3</sub> , BaO<sub>2</sub> , Cl<sub>2</sub>O<sub>4</sub>, K<sub>2</sub>SnO<sub>3</sub>, H<sub>2</sub>N<sub>2</sub>O<sub>2</sub>, CaB<sub>2</sub>O<sub>4</sub>, Cr<sub>2</sub>O<sub>4</sub><sup>2-</sup>, Cr<sub>2</sub>O<sub>7</sub><sup>2-</sup>, AsO<sub>4</sub><sup>3-</sup>, MnO<sub>4</sub><sup>-</sup>, HOBr, HBrO<sub>2</sub>, HBrO<sub>3</sub>, HBrO<sub>4</sub>, SCl<sub>2</sub>, PCl<sub>3</sub>, BCl<sub>3</sub>, SnH<sub>4</sub>, SbCl<sub>5</sub>, SeF<sub>6</sub> | :H<sub>2</sub>O, MgO, Al<sub>2</sub>O<sub>3</sub>, NaCl, N<sub>2</sub>, NaOH, NH<sub>3</sub>, SO<sub>2</sub>, CaO, H<sub>2</sub>S, SO<sub>3</sub>, K<sub>2</sub>O, Na<sub>2</sub>CO<sub>3</sub> , N<sub>2</sub>O<sub>3</sub> , BaO<sub>2</sub> , Cl<sub>2</sub>O<sub>4</sub>, K<sub>2</sub>SnO<sub>3</sub>, H<sub>2</sub>N<sub>2</sub>O<sub>2</sub>, CaB<sub>2</sub>O<sub>4</sub>, Cr<sub>2</sub>O<sub>4</sub><sup>2-</sup>, Cr<sub>2</sub>O<sub>7</sub><sup>2-</sup>, AsO<sub>4</sub><sup>3-</sup>, MnO<sub>4</sub><sup>-</sup>, HOBr, HBrO<sub>2</sub>, HBrO<sub>3</sub>, HBrO<sub>4</sub>, SCl<sub>2</sub>, PCl<sub>3</sub>, BCl<sub>3</sub>, SnH<sub>4</sub>, SbCl<sub>5</sub>, SeF<sub>6</sub> | ||
<popup name="Lösungen"> | <popup name="Lösungen"> | ||
<center>[[File:Lösungen Oxidationszahlen-Übung1.png|800px]]</center> | <center>[[File:Lösungen Oxidationszahlen-Übung1.png|800px]]</center> | ||
| + | Achtung Fehlerteufel: Die Oxidationszahlen bei Cr<sub>2</sub>O<sub>4</sub><sup>2-</sup>, Cr<sub>2</sub>O<sub>7</sub><sup>2-</sup> und SnH<sub>4</sub> sind falsch! | ||
</popup> | </popup> | ||
}} | }} | ||
| Zeile 221: | Zeile 220: | ||
<center>[[File:Lösungen Oxidationszahlen-Übung2.png|800px]]</center> | <center>[[File:Lösungen Oxidationszahlen-Übung2.png|800px]]</center> | ||
</popup> | </popup> | ||
| + | }} | ||
| + | |||
| + | {{Versuch+|'''Reaktionen von Ionenlösungen|''' | ||
| + | Was passiert wenn eine Ionenlösung auf eine andere trifft? Das sollst du in diesem Experiment untersuchen. | ||
| + | ::→ Zur Anleitungsseite | ||
| + | * Gefährdungsbeurteilung | ||
}} | }} | ||
| Zeile 248: | Zeile 253: | ||
Zur Überprüfung können alle ermittelten Oxidationszahlen addiert werden. Ihre Summe muss insgesamt Null ergeben, wenn das Gesamtmolekül ungeladen ist - wie es vorher auch schon war. | Zur Überprüfung können alle ermittelten Oxidationszahlen addiert werden. Ihre Summe muss insgesamt Null ergeben, wenn das Gesamtmolekül ungeladen ist - wie es vorher auch schon war. | ||
| + | |||
| + | {{AufgabeNr|7|2=Der Nachweis des Atemalkoholgehaltes wurde vor der Einführung eines elektronischen Messgerätes "Chemisch" bestimmt. | ||
| + | [[Datei:Bafometro-BrDSC 7400.jpg|250px|miniatur|rechts]] | ||
| + | :''Die bereits 1953 entwickelten Blasröhrchen basieren auf einer chemischen Reaktion, wobei das in der Atemluft enthaltene Ethanol dabei mit den im Röhrchen befindlichen Chemikalien reagiert, was durch eine Farbveränderung sichtbar wird. Jedes Röhrchen enthält eine Mischung aus Kaliumdichromat und Schwefelsäure auf einer unreaktiven Trägersubstanz aus Kieselgel. Wird mit der Ausatemluft Ethanol durch diese Mischung geblasen, so wird das Ethanol zu Acetaldehyd (= Ethanal) oxidiert und das orangerote Kaliumdichromat zu grünem Chrom(III)-sulfat reduziert. Die Schwefelsäure dient als Protonendonator, da die Reaktion im sauren Milieu stattfindet. Außerdem bindet sie das entstehende Wasser, um eine Weiterreaktion des Acetaldehyds zu vermeiden. Die Länge der Verfärbung des Packungsbetts gibt einen groben Hinweis auf den Gehalt an Ethanol. Mittels einer aufgedruckten Linie kann die Überschreitung eines Grenzwerts kenntlich gemacht werden. Die Reaktion läuft wie folgt ab:'' | ||
| + | |||
| + | :<math>\mathrm{3 \ CH_{3}CH_2OH + K_2Cr_{2}O_7 + 4 \ H_2SO_4 \longrightarrow 3 \ CH_{3}CHO + Cr_2(SO_4)_3 + 7 \ H_2O + K_2SO_4}</math> | ||
| + | |||
| + | <u>Aufgabe:</u> Bestimme die Oxidationszahlen, um nachzuweisen, dass eine Oxidation und eine Reduktion stattfinden. | ||
| + | }} | ||
=== Eigenschaften von Brom und den anderen Halogenen === | === Eigenschaften von Brom und den anderen Halogenen === | ||
| Zeile 287: | Zeile 301: | ||
| − | {{AufgabeNr| | + | {{AufgabeNr|8 - Vorbereitung der Tabelle|Bereite eine Tabelle vor, in der die Eigenschaften der Halogene im Vergleich eingetragen werden sollen. Außerdem soll Platz gelassen werden, um zu Begründen, warum dies so ist.}} |
| − | {{AufgabeNr| | + | {{AufgabeNr|8a - Schmelz- und Siedetemperaturen erklären|Trage als erste die Schmelz- und Siedetemperaturen ein. |
}} | }} | ||
| − | {{AufgabeNr| | + | {{AufgabeNr|8b - | |
}} | }} | ||
=== Experimente zu den Halogenen === | === Experimente zu den Halogenen === | ||
| + | |||
{{Versuch+|'''Nachweis von Halogeniden mit Hilfe von Silbernitrat'''| | {{Versuch+|'''Nachweis von Halogeniden mit Hilfe von Silbernitrat'''| | ||
| − | Dies ist ein sehr einfacher Versuch zum Nachweis von Halogeniden, allerdings sind die Unterschiede zwischen den verschiedenen Halogeniden nicht sehr deutlich! → Zur Anleitungsseite | + | Dies ist ein sehr einfacher Versuch zum Nachweis von Halogeniden, allerdings sind die Unterschiede zwischen den verschiedenen Halogeniden nicht sehr deutlich! |
| − | * [https://www.experimentas.de/experiments/view/29.pdf Gefährdungsbeurteilung zum Experiment] | + | ::→ Zur Anleitungsseite |
| − | }} | + | * [https://www.experimentas.de/experiments/view/29.pdf Gefährdungsbeurteilung zum Experiment]}} |
| + | |||
| + | |||
| + | {{Versuch+|'''Reaktionen von Halogeniden mit Halogenen'''| | ||
| + | Halogene nicht ganz ungefährlich, aber in Form von stark verdünnten, wässrigen Lösungen ist die Gefahr nicht mehr so groß und daher können wir mit Bromwasser und Chlorwasser experimentieren. | ||
| + | ::→ Zur Anleitungsseite | ||
| + | * Gefährdungsbeurteilung zum Experiment}} | ||
== Quellen im Internet == | == Quellen im Internet == | ||
| Zeile 313: | Zeile 334: | ||
[[Kategorie:Redoxreaktionen]] | [[Kategorie:Redoxreaktionen]] | ||
[[Kategorie:Halogene]] | [[Kategorie:Halogene]] | ||
| + | [[Kategorie:Oxidationszahl]] | ||
| + | [[Kategorie:Elemente]] | ||
| + | [[Kategorie:Hauptgruppe]] | ||
| + | [[Kategorie:Periodensystem]] | ||
Aktuelle Version vom 13. November 2017, 14:56 Uhr
Inhaltsverzeichnis |
Warum Brom?
Über einer dunklen, rotbraunen Flüssigkeit wabert ein schwerer, rotbrauner Dampf, der sich im Raum verteilt. Seinen Namen verdankt Brom dem griechischen Begriff für Gestank (= brômos), den Brom zurecht hat, denn Bromdampf hat einen intensiven, chlorähnliches Geruch, den man schon in kleinsten Mengen wahrnehmen kann. Den sollte man sich aber nicht zu häufig antun, denn Brom ist giftiger als Chlor. Deshalb ist elementares Brom in den Schulen (zumindest in Schülerversuchen) verboten, zumal eine umgeworfene und ausgekippte Flasche Brom meist zur Evakuierung der gesamte Schule führt (Feuerwehr-Bericht als Beispiel)
Trotz seiner unangenehmen Eigenschaften gibt es zahlreiche Einsatzgebiete für das "Teufelszeug", von denen hier nur eine kleine Auswahl genannt wird. Eine ausführlichere und genauer Liste liefert der Wikipedia-Artikel 19px Brom :
- es gibt organische Bromverbindungen, die als Flammschutzmittel dienen
- früher gab es zahlreiche Medikamente, die Brom bzw. Bromide enthielten, heute gibt es besseren Ersatz
- für die Fotoindustrie wird Silberbromid als lichtempfindliche Suspension verwendet, die auf Fotoplatten verwendet wird
- im Labor dient es zum Nachweis von Doppel- und Dreifachbindungen
- Bromlösungen können als mildes Desinfektionsmittel verwendet werden (milder als Chlor)
Anhand des Broms werden wir einige Themen aus der Mittelstufe wieder aufgreifen und vertiefen und damit erklären, woher die Eigenschaften von Brom und Bromverbindungen kommen, um diese dann auf die anderen Halogene übertragen zu können.
Gewinnung von Brom am Toten Meer
Das Tote Meer ist ein abflussloser See, dessen Wasseroberfläche etwa 428 m unter dem Meeresspiegel liegt. Die Entstehung dieses tiefen, schmalen und langen Landstreifens, der als "syrisch-afrikanischen Riss" bezeichnet wird, lässt sich dadurch erklären, das dieses Gebiet in der Erdkruste abgesunken ist. Dies geschah allerdings geschätzt vor mehreren Hundert-Millionen Jahren. Das Tote Meer wird vom Jordan gespeist und ist für seinen hohen Salzgehalt bekannt Er grenzt an Jordanien, Israel und das von Israel besetzte Westjordanland.
Das besondere am Toten Meer ist der Salzgehalt von bis zu 33 %, im Durchschnitt ist er bei etwa 28 %. Zum Vergleich dazu ist der Salzgehalt des Mittelmeeres mit nur etwa 3,8 % wesentlich geringer. Aufgrund des hohen Salzgehalts hat das Seewasser eine Dichte von ca. 1,240 kg/l.
Diese hohe Salzkonzentration ist dadurch entstanden, das es durch den Zufluss von Wasser aus dem Jordan und aufgrund des trockenen Wüstenklima stetig verdunstenden Wassers, zu einer Anreicherung von Mineralien und Salzen kommt. Der Zufluss von Jordanwasser und den Entzug von Verdunstungswasser haben sich mit der Zeit auf die Höhe des aktuellen Wasserspiegels eingependelt. Negativ beeinflusst wird der Wasserpegel durch die künstliche Verdunstung der kommerziellen Salzgewinnung.
- PikiWiki Israel 32639 Ein Feshkha.JPG
Blick von 19px Ain_Feshkha im Westjordanland auf das Tote Meer.
- Dead sea newspaper.jpg
Aufgrund der hohen Dichte, kann man sich ins Wasser legen und bequem lesen.
- Dead Sea Halite View 031712.jpg
Ausgedehnte Salzkrusten am Strand.
Entgegen dem Namen ist das Tote Meer übrigens biologisch nicht tot, jedoch beschränkt sich das Leben weitgehend auf verschiedene Lebewesen und Pflanzen, die an die extremen Bedingungen angepasst sind. Es gibt vor allem halophile (=salzliebende) Mikroorganismen, wie zum Beispiel anaerobe (=Leben ohne Sauerstoff) Bakterien die zum Beispiel Salpeter, Schwefel und Cellulose abbauen. Auch manche Pflanzen mit großer Salztoleranz können in dieser extremen Umwelt überleben.
Warum die Brom-Gewinnung am Toten Meer?
Die größten Brom-Produzenten sind die Vereinigten Staaten, China, Israel, sowie Jordanien. Nach den zwei Riesenindustriestaaten kommen die zwei der Anrainer des Totes Meeres. In sofern scheint es klar zu sein, dass es da Zusammenhang geben muss. Neben der hohen Salzkonzentration gibt es nämlich auch noch deutliche Unterschiede bei der Zusammensetzung des Salzes des Toten Meeres im Vergleich zu normalem Meerwasser.
| Bestandteil | Anteil in Prozent im trockenen Salz | Mengen im Wasser des Toten Meer |
|---|---|---|
| MgCl2 | 50 % | 22 Mill. t |
| NaCl | 30 % | 12,5 Mill. t |
| CaCl2 | 14 % | 6 Mill. t |
| KCl (Pottasche) | 4 % | 2 Mill. t |
| MgBr2 | 2% | 1 Mill. t |
| CaSO4(Gips) | 0,2 % | 0,215 Mill. t |
Scheinbar nicht sonderlich hoch aber dennoch bemerkenswert ist dabei vor allem das Verhältnis von Chlorid- zu Bromid-Ionen. Im Mittelmeer beträgt das Verhältnis von Chlorid- zu Bromid-Ionen 280 : 1, dagegen ist das Verhältnis im Wasser des Toten Meeres 40 : 1. Damit ist das Tote Meer das Gewässer mit dem höchsten Bromid-Gehalt weltweit.
| Zur Erinnerung: Die einfach negativ geladenen Ionen der Elemente der 7. Hauptgruppe nennt man entsprechend des Gruppennamens allgemein Halogenid-Ion, entsprechend ist F⊖ Fluorid-Ion, Cl⊖ Chlorid-Ion, Br⊖ Bromid-Ion und I⊖ Iodid-Ion. |
Was die Gewinnung am Toten Meer sinnvoll und vor allem wirtschaftlich macht, ist das in der Gegend vorherrschende Klima. Am Toten Meer ist es ganzjährig sonnig bei gleichzeitig geringer Luftfeuchtigkeit und stetigem leichten Wind. Im Jahresverlauf fallen weniger als 50 mm Niederschlag. Die Höchsttemperaturen bewegen sich im Sommer zwischen 32 und 39 °C, im Winter zwischen 20 und 23 °C. Überr die Hälfte des Jahres ist die Tageshöchsttemperatur über 30 °C.
Diese Bedingungen ermöglichen eine Anreicherung des Salzwasser in großen Verdunstungsbecken am südlichen Ende des Toten Meeres. Nachdem einige Bestandteile - vor allem MgCl und NaCl - zum Teil ausgefallen sind, erreicht die Konzentration 10-12 g/l, bei einem Verhältnis von Chlorid- zu Bromid-Ionen 17 : 1.
| Ausfällen: Durch Verdunstung, und damit Veringerung, des Lösungmittels erhöht sich die Konzentration des Salzes immer mehr. Irgendwann reicht die Menge des Lösungsmittels nicht mehr aus, um das gelöste Salz in Lösung zu halten. Es fällt aus, d.h. es bildet sich am Boden ein fester Bodensatz von nicht mehr löslichem Salz. |
Auf Israelischer Seite wird das Brom seit etwa 1900 industriell in der Dead Sea Bromine Company, hergestellt, die ein Bestandteil der israelischen staatlichen Firma Deas Sea Works ist. Neben Brom stellt die Dead Sea Works auch Magnesiumchlorid, Industriesalz, Flugzeugenteisungsmittel, Badesalz, Tafelsalz sowie Rohmaterial für die Kosmetikindustrie her. Weltweit ist die Gesellschaft an vierter Stelle beim Abbau von Kaliprodukten.
Der Prozeß zur Gewinnung von Brom
Hinter der Gewinnung von Brom aus einer Bromid-Lösung steckt im wesentlichen die Reaktion, die im folgenden Film gezeigt wird.
Die Rotfärbung der Flüssigkeit zeigt, dass Brom entstanden ist, das sich gleich im Wasser gelöst hat. Im Labormaßstab geht die Gewinnung von elementaren Brom also recht einfach, indem man Chlorgas in die Bromidsalzlösung einleitet. Damit sich der Aufwand für eine industrielle Gewinnung - auch unter Beachtung der Sicherheitsmaßnahmen - lohnt, musste ein Verfahren entwickelt werden, in dem kontinuierlich und ohne Unterbrechung der Produktionsprozess stattfinden kann. Das folgende Bild zeigt den Ablauf mit seinen einzelnen Stationen.
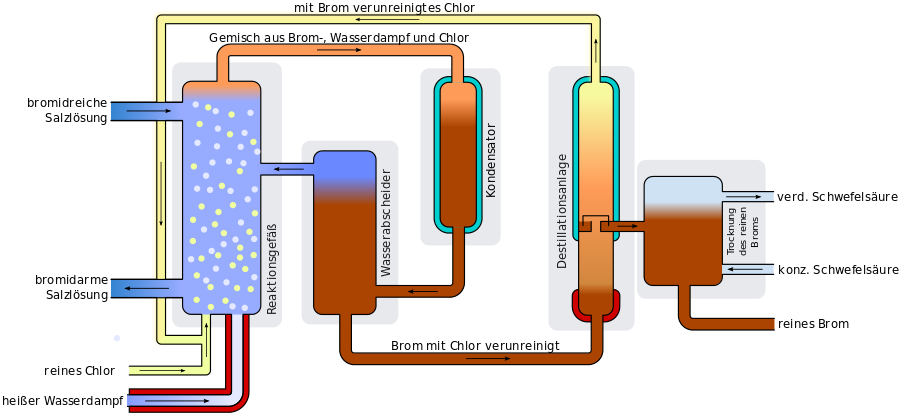
Das Wasser aus dem Toten Meer wird in den Verdunstungsbecken konzentriert, wobei von der sehr viel größeren Menge der Chloridverbindungen ein Teil ausfällt. Dadurch wird der Anteil an Bromid-Ionen erhöht. Diese Lösung wird in die Produktionsanlage geleitet, wo in größeren Behältern die Lösung von heißem Dampf und Chlorgas durchströmt wird. Das Chlor reagiert mit den Bromid-Ionen und es entsteht Brom. Das noch enthaltene, gelöste Salz mit Chlorid-Ionen stört diesen Vorgang nicht und bleibt unverändert.
Durch die Wärme des Dampfes verdunstet das Brom und wird zusammen mit nicht reagiertem Chlor abgeleitet. In einem Kühler wird das Brom, Chlor und auch auch verdunstetes Wasser kondensiert. Das Wasser kann abgetrennt werden, da flüssiges Brom sich nicht mit Wasser mischt und sich aufgrund der höheren Dichte unten absetzt. Um das nun vor allem noch mit Chlor versetzte Brom zu reinigen wird es destilliert und wieder so kondensiert, dass kein Chlor mehr enthalten ist. Das immer noch mit Bromresten verunreinigte restliche Chlorgas kann wieder in den Reaktionsbehälter zurückgeleitet werden, ergänzt um neues Chlor.
Abschließend wird das Brom noch von restlichem Wasser gereinigt, indem hochkonzentrierte Schwefelsäure hinzugefügt wird, dass das Wasser aufnimmt und dann als verdünne Schwefelsäure wieder abgeleitet wird. Das nun reine Brom wird abgeleitet und abtransportiert werden.
Die Ausbeute in der Produktion kann verbessert werden, wenn das meist etwas alkalische Meerwasser mit Hilfe von Schwefelsäure angesäuert wird. Ansonsten würden elementares Brom und Chlor mit dem Wasser reagieren und zunächst Bromwasserstoff bzw. Chlorwasserstoff (=Salzsäuregas) bilden, die den pH-Wert neutralisieren. Dabei wird aber auch die Ausbeute an Brom verringert.
Redoxreaktionen am Beispiel der Bromgewinnung
Im Text des letzten Abschnitts wird nicht nur der technische Ablauf beschrieben, sondern auch welche Stoffe bei der Reaktion beteiligt sind. Den chemischen Vorgang werden wir uns nun genauer anschauen.
30px Aufgabe 1
Beantworte die folgenden Fragen, um zu testen, ob du verstanden hast, was chemisch dabei passiert. |
30px Aufgabe 2
Halte die Reaktion, die bei der Gewinnung von Brom stattfindet, fest und bestimme die Oxidation und Reduktion, sowie das Oxidations- und das Reduktionsmittel. |
Zur Erinnerung:
|
Unter einem Redoxpaar versteht man ein paar von Teilchen, die durch Auf- bzw. Abnahme ineinander überführt werden können.Zum Beispiel:
Allgemein kann man es so formulieren (wobei Ladungen der Ionen nicht angegeben sind): |
30px Aufgabe 3
Auf einer Unterseite gibt es eine größere Sammlung von Aufgaben, bei denen du die Anwendung der Begriffe zu den Redoxreaktionen ausführlich üben kannst. → Übungen zum Redoxbegriff |
Bestimmung der Oxidationszahl bei einfachen Verbindungen
Um festzustellen, ob eine Oxidation oder eine Reduktion bei einem Redoxpaar stattfindet haben wir bisher immer die Ladungen der Ionen betrachtet. Das ist bei zusammengesetzen Ionen, wie 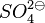 oder
oder 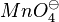 nicht möglich, da das geladene Teilchen ein zusammenhängendes Molekül ist.
nicht möglich, da das geladene Teilchen ein zusammenhängendes Molekül ist.
Man nutzt dann die Oxidationszahl (manchmal auch Oxidationsstufe, Oxidationswert, elektrochemische Wertigkeit), die die theoretische Ionenladung eines Atoms innerhalb einer chemischen Verbindung oder eines mehratomigen Ions angibt. Dabei geht man davon aus, dass das zusammengesetzte Molekül in Ionen zerlegt wird. Anders als bei den tatsächlichen Ionenladungen, die als Zahl mit nachgestelltem 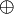 oder
oder 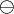 geschrieben werden, wird bei Oxidationszahlen das + oder − als Vorzeichen vorangestellt und die Zahl mit römischen Ziffern angegeben. Im Falle der Oxidationszahl null wird ±0 geschrieben.
geschrieben werden, wird bei Oxidationszahlen das + oder − als Vorzeichen vorangestellt und die Zahl mit römischen Ziffern angegeben. Im Falle der Oxidationszahl null wird ±0 geschrieben.
| Die Oxidationszahl ist eine gedachte Ladung eines Atoms innerhalb einer chemischen Verbindung oder eines mehratomigen Ions. Eine wesentliche Rolle spielt dabei die Elektronegativität, bei anorganischen Verbindungen kann man sich auf einige Regeln zur Bestimmung konzentrieren. |
30px Aufgabe 4 - Wiederholung: Benennung von wichtigen Ionen und Ionenverbindungen
Da wir uns gleich einige der wichtigen und häufig verwendeten mehratomigen Ionen anschauen, wiederholen wir an der Stelle noch einmal einige Namen dieser Ionen und auch wie man Ionenverbindungen benennt und die Formel angibt.
|
Bei den einzelnen Ionen, vor allem den Hauptgruppen-Elementen, nutzen wir die Hauptgruppennummer, um die Ladung zu bestimmen. Dabei wird die Edelgasregel benutzt. Diese Edelgasregel ist zwar wichtig und richtig, aber sie gilt gerade bei Elementen ab der 3. Periode nicht mehr so streng. Das liegt vor allem daran, dass in der 3. Schale mehr als 8 Elektronen Platz haben.
Wie schon erwähnt, spielt die Elektronegativität ein Rolle. Allerdings werden wir, statt immer ins PSE gucken zu müssen, einige Regeln festhalten, mit denen man auch ohne die Elektronegativität entscheiden kann, wie die Oxidationszahl eines Atoms in der Verbindung ist. Hinter diesen Regeln steht aber die Elektronegativität, denn in einer Verbindung werden bindende Elektronenpaare gedanklich dem elektronegativeren Bindungspartner zugewiesen (Fachbegriff: heterolytische Spaltung).
| Nr. | Regel | Erklärung | Beispiele |
|---|---|---|---|
| 1 | Atome im elementaren Zustand haben immer die Oxidationszahl ±0 | Die Atome haben die Elektronenanzahl, die zum Kern passt, also ist die Ladung 0 | I2, C, O2, P4, S8 |
| 2 | Bei einatomigen Ionen entspricht die Oxidationszahl der Ionenladung | wie bisher | Cu2+ hat die Oxidationszahl +II, Ag+ hat die Oxidationszahl +I |
| 3 | Die Summe aller Oxidationszahlen in einer Verbindung/einem Molekül entspricht der Ladung | Die Gesamt-Ladung (e- und p+) muss stimmen. Das kann bei einer neutralen Verbindung zusammen Null sein, bei einem geladenen Molekül ist es dessen Ladung. | CH4 → C -IV und H je +I also -4 + 4*(+1) = 0 SO42- → S + VI und O -II also +6 + 4*(-2) = -2 |
| 4 | Fluor hat in Verbindungen immer die Oxidationszahl −I | Wegen der höchsten Elektronegativität | KF, HF, ... |
| 5 | Sauerstoff hat meist die Oxidationszahl −2 Ausnahmen: In Peroxiden (mit -O-O-) und in Verbindungen mit Fluor. |
Die Fluor-Regel hat eine höhere Priorität! | H2O2 → O -I und H +I, OF2 → O +II und F -I |
| 6 | Weitere Halogenatome (Cl, Br, I) haben meist die Oxidationszahl −I Ausnahmen: In Verbindungen mit Fluor, Sauerstoff und einem anderen Halogen mit höherem EN-Wert |
Die vorherigen Regeln haben Vorrang und wegen der Defintion der Elektronegativität | ClO2 → Cl +IV und O -II BrCl → Br +I und Cl -I |
| 7 | Metallatome haben in Verbindungen immer eine positive Oxidationszahl Ausnahme: Halbmetalle können sich auch wie Nichtmetalle verhalten. |
Metalle geben Elektronen leicht ab. | Na+, Hg2+, Al3+, Si4+, As5+, ... aber: Natriumarsenid Na3As → Na +I und As -III |
| 8 | Alkalimetalle haben als Oxidationszahl +I und Erdalkalimetalle +II | Ergibt sich aus der Edelgasregel. | Beispiel |
| 9 | Wasserstoffatome bekommen die Oxidationszahl +I Ausnahmen: Wenn Wasserstoff mit „elektropositiveren“ Atomen wie Metallen oder sich selbst direkt verbunden ist. |
Wegen der Defintion der Elektronegativität. | H2O → H +I und O -II und HCl → H +I und Cl -I aber: Natriumhydrid NaH → Na +I und H -I |
Abschließend ist ein Blick nach "draußen" vielleicht einmal interessant mit der 19px Liste aller möglichen Oxidationszahlen und einen Artikel der Zeitschrift "Nature", wo von dem Element mit der bisher höchsten Oxidationsstufe +IX berichtet wird.
30px Aufgabe 5 - Bestimmung der Oxidationszahlen in anorganischen Verbindungen und Molekül-Ionen
Hier gibt es zum Austoben ein paar Aufgaben ... Bestimmt die Oxidationszahlen in den folgenden Verbindungen:
|
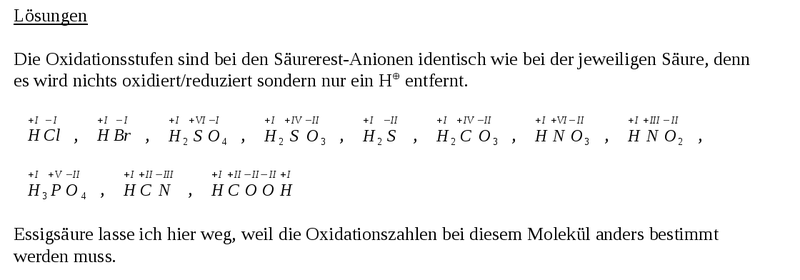
30px Aufgabe 6 - Bestimmung der Oxidationszahlen bei Säurerest-Ionen
Bestimme auf dem Arbeitsblatt mit den Säurerest-Ionen die Oxidationszahlen aller Atome. |
| VERSUCH: Reaktionen von Ionenlösungen
Was passiert wenn eine Ionenlösung auf eine andere trifft? Das sollst du in diesem Experiment untersuchen.
|
Bestimmung der Oxidationszahl bei komplexen Verbindungen
Komplexe Verbindungen sind meist organische Verbindungen bei denen besonders der Kohlenstoff mit verschiedenen Atomen verbunden sein kann, wie Wasserstoff, Sauerstoff, Stickstoff, Halogene usw. Dadurch kann der Kohlenstoff ganz verschiedene Oxidationszahlen annehmen, durchaus auch verschiedene in einem Molekül.
Beispielhaft sei das bei der Oxidation des Alkohols Ethanol betrachtet:
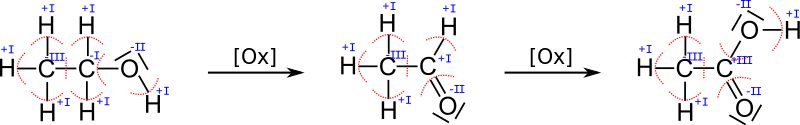
Obwohl sich die Menge an Sauerstoff vom Ethanol zum Ethanal nicht erhöht, ändert sich die Oxidationszahl.
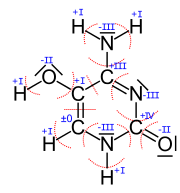
Man braucht dann, um die Oxidationszahlen zu bestimmen, die Lewisschreibweise/Strukturformel des Moleküls. Dann sucht man sich die Elektronegativität der beteiligten Elemente heraus und spaltet gedanklich jede Bindung auf und somit das ganze Molekül in einzelne Ionen auf. Welches der Bindungspartner die jeweiligen Bindungselektronen bekommt, ist abhängig von der Elektronegativität: das Atom mit der größeren Elektronegativität erhält die Bindungselektronen zwischen den zwei Partnern. Diese gedachten Ionen werden dann meist eine Elektronenanzahl (bzw. die Valenzelektronen/Außenelektronen) haben, die nicht der normalen Anzahl entspricht. Daraus ergibt sich eine Ladung, die dann der Oxidationszahl entspricht.
Vorab suchen wir für alle beteiligten Atomsorten die Elektronegativitätswerte heraus. Man sollte sich dazu auf eine Quelle beschränken, damit man nicht Werte aus verschiedenen Skalen mischt:
- EN(C) = 2.5 , EN(H) = 2.2, EN(O) = 3.5, EN(N) = 3.07
Betrachten wir anhand von zwei C-Atomen beispielhaft die Vorgehensweise:
- Das linke untere C (die Oxidationszahl ±0 hat) ist unter anderem mit einem C verbunden. Da beide den gleichen EN-Wert haben, teilt man die zwei Bindungselektronenpaare gleichmäßig auf. Außerdem hängt daran ein N-Atom, dass einen höheren EN-Wert hat als der Kohlenstoff (EN(C) < EN(N)). Deshalb zählt man das Elektronenpaar zwischen diesen zwei Atomen zum Stickstoff. Die Bindung zum H-Atom wird zum C-Atom gezählt, da EN(C) > EN(H). Die roten Kreisbögen machen die Zuordnung deutlich. Nun zähle ich die Elektronen, die aufgrund von dieser Entscheidung/Markierung zu dem betrachteten C-Atom gehören und das sind 4 Stück (2 von der Bindung zum H und zweimal je 1 von der Doppelbindung zum anderen C-Atom). Damit hat dieses Kohlenstoff-Atom gleichviele Elektronen wie im normalen Zustand (laut Periodensystem) und somit ist die Oxidationszahl ±0.
- Das untere rechte C-Atom bekommt keines der Bindunselektronenpaare zugesprochen, da die Bindungspartner alle einen höheren EN-Wert haben. Ohne Elektronen fehlen also 4 Elektronen zum Normalzustand (weniger negative Ladung) und damit überwiegt die positive Ladung und zwar hat man dann +IV.
- Das untere mittlere Stickstoffatom hat nach der Aufteilung 8 Elektronen zugesprochen bekommen. Im Vergleich zu den 5 Außenelektronen, die es normalerweise hat sind das 3 Elektronen zuviel, also hat man die Oxidationszahl -III.
Zur Überprüfung können alle ermittelten Oxidationszahlen addiert werden. Ihre Summe muss insgesamt Null ergeben, wenn das Gesamtmolekül ungeladen ist - wie es vorher auch schon war.
30px Aufgabe 7
Der Nachweis des Atemalkoholgehaltes wurde vor der Einführung eines elektronischen Messgerätes "Chemisch" bestimmt.
Aufgabe: Bestimme die Oxidationszahlen, um nachzuweisen, dass eine Oxidation und eine Reduktion stattfinden. |
Eigenschaften von Brom und den anderen Halogenen
Um zu verstehen, wie die Bromgewinnung funktioniert und warum sich Halogene und ihre Verbindungen so verhalten, schauen wir uns die Hauptgruppe der Halogene noch einmal genauer an.
Das fünfte Halogen Astat ist sehr selten. Schätzungen zufolge gibt es in der ganze Erdkruste nur 25 g davon. Wir konzentrieren uns deshalb auf die erste vier Halogene. Zunächst einmal ein paar Bilder der Elemente in verschiedenen Aggregatzuständen.
- Chlorine liquid in an ampoule.jpg
Flüssiges Chlor ist kräftig gelb gefärbt.
- Liquid and gaseous chlorine.jpg
Gasförmiges Chlor ist nur schwach gelb gefärbt, was hier aber auch daran liegt, dass es nur eine dünne Ampulle ist.
- Die chemischen elemente cl.jpg
Im festen Zustand ist Chlor auch kräftig gelb und sieht wachsartig aus.
- Bromine vial in acrylic cube.jpg
Im flüssigen Zustand ist Brom dunkelrot gefärbt und auch der Bromdampf ist deutlich zu sehen.
- Iodine-evaporating.jpg
Iod ist zwar auch bei Raumtemperatur ein Feststoff, aber ist es sehr flüchtig und die Iod-Dampfe sind deutlich sichtbar.
- Iodinecrystals.JPG
Festes Iod hat einen deutlich sichtbaren, metallischen Glanz.
Sehr informative Videos zu den Eigenschaften und der Gewinnung der Halogene sind auf dem Omega-Medien-Server. Sie sind zwar recht alt, aber immer noch gut. Diese Videos sind aber nur einsehbar, wenn man angemeldet ist!
Die folgenden Videos sind frei verfügbar aber alle auf englisch. Jedes der vier Halogen wird ausführlich vorgestellt, zum Astat gibt es auch ein kurzes Video.
| Fluor | Chlor | Brom | Iod | Astat |
|---|---|---|---|---|
30px Aufgabe 8 - Vorbereitung der Tabelle
Bereite eine Tabelle vor, in der die Eigenschaften der Halogene im Vergleich eingetragen werden sollen. Außerdem soll Platz gelassen werden, um zu Begründen, warum dies so ist. |
30px Aufgabe 8a - Schmelz- und Siedetemperaturen erklären
Trage als erste die Schmelz- und Siedetemperaturen ein.
|
30px Aufgabe 8b -
|
Experimente zu den Halogenen
| VERSUCH: Nachweis von Halogeniden mit Hilfe von Silbernitrat
Dies ist ein sehr einfacher Versuch zum Nachweis von Halogeniden, allerdings sind die Unterschiede zwischen den verschiedenen Halogeniden nicht sehr deutlich!
|
| VERSUCH: Reaktionen von Halogeniden mit Halogenen
Halogene nicht ganz ungefährlich, aber in Form von stark verdünnten, wässrigen Lösungen ist die Gefahr nicht mehr so groß und daher können wir mit Bromwasser und Chlorwasser experimentieren.
|
Quellen im Internet
- Das Brom-Buch (auf englisch) wurde vom Israelischen Weizmann Institut of Science und der schon erwähnten Dead Sea Bromine Group herausgegeben. In mehreren Kapiteln bekommt man wirklich sehr ausführliche Informationen zu Brom, dessen Gewinnung und Verwendung.
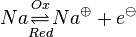 und
und