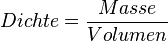Sauber und schön: Unterschied zwischen den Versionen
(→Löslich oder nicht löslich?) |
(→Löslich oder nicht löslich?) |
||
| (40 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
<center><big>'''Sauber und schön?'''</big></center> | <center><big>'''Sauber und schön?'''</big></center> | ||
<center> | <center> | ||
| − | <gallery heights= | + | <gallery heights=250px widths=300px> |
File:Waschmaschine Historisch.jpg|Alte Waschmachine, die nach dem gleichen Prinzip funktioniert wie heute | File:Waschmaschine Historisch.jpg|Alte Waschmachine, die nach dem gleichen Prinzip funktioniert wie heute | ||
File:Bundesarchiv Bild 102-09247, Berlinerin im Schaumbad.jpg|Welche Bedeutung das Reinigungsmittel, wie Seife? | File:Bundesarchiv Bild 102-09247, Berlinerin im Schaumbad.jpg|Welche Bedeutung das Reinigungsmittel, wie Seife? | ||
| Zeile 15: | Zeile 15: | ||
* der Schmutz in einem geeigneten Lösungsmittel besser löslich ist als "in" der Faser und so aus der Faser herausgespült werden kann. | * der Schmutz in einem geeigneten Lösungsmittel besser löslich ist als "in" der Faser und so aus der Faser herausgespült werden kann. | ||
::Typische Reinigungsmittel: Wasser, Reinigungsbenzin ''(als ein Beispiel ähnlicher Stoffe)'', Hilfsmittel wie Seife | ::Typische Reinigungsmittel: Wasser, Reinigungsbenzin ''(als ein Beispiel ähnlicher Stoffe)'', Hilfsmittel wie Seife | ||
| − | * Schmutz, der nicht an der | + | * Schmutz, der nicht an der Oberfläche haftet/klebt, durch ausreichend Bewegung mechanisch heraustransportiert wird. |
| − | * | + | * Verunreinigung biologischer Art ''(Bakterien verursachen unangenehmen Geruch)'' abgetötet wird. |
}} | }} | ||
| Zeile 23: | Zeile 23: | ||
== Löslich oder nicht löslich? == | == Löslich oder nicht löslich? == | ||
{{Kurzregel|Zwei Stoffe sind ineinander löslich, wenn beim Vermischen ein '''homogenes Gemisch''' entsteht. | {{Kurzregel|Zwei Stoffe sind ineinander löslich, wenn beim Vermischen ein '''homogenes Gemisch''' entsteht. | ||
| − | * Bei '''homogenen Gemischen''' sieht man nicht, dass sie aus mehreren Bestandteilen bestehen. ''Sie sind '''einphasig'''.'' | + | * Bei '''homogenen Gemischen''' sieht man nicht, dass sie aus mehreren Bestandteilen bestehen. ''Sie sind '''einphasig'''.'' Die gelösten Teilchen liegen einzeln vor. |
| − | * Bei '''heterogenen Gemischen''' sieht man, dass sie mehrere Bestandteile enthalten. Sie haben mindestens zwei Phasen. | + | * Bei '''heterogenen Gemischen''' sieht man, dass sie mehrere Bestandteile enthalten. Sie haben mindestens zwei Phasen. Die Teilchen des gelösten Stoffes liegen in Gruppen/Partikeln vor. |
}} | }} | ||
'''Beispiele:''' | '''Beispiele:''' | ||
| − | * <u>Milch</u> | + | * <u>Milch</u> |
| − | <center><gallery> | + | |
| + | <center><gallery heights=250 widths=250> | ||
Datei:Milk glass.jpg|Von außen sieht man keine zwei Bestandteile | Datei:Milk glass.jpg|Von außen sieht man keine zwei Bestandteile | ||
Datei:Milkccar.jpg|... genauer betrachtet sieht man die Fetttröpfchen | Datei:Milkccar.jpg|... genauer betrachtet sieht man die Fetttröpfchen | ||
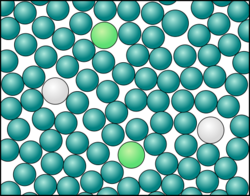
Teilchenmodell Emulsion.png|Teilchenmodell dazu - Was ist was? | Teilchenmodell Emulsion.png|Teilchenmodell dazu - Was ist was? | ||
</gallery></center> | </gallery></center> | ||
| − | * <u>Lösungen von Salz oder Kohlendioxid in Wasser</u> | + | <popup name="Lösung">Milch ist '''kein homogenes Gemisch''', denn mit einem Mikroskop kann man kleine Fetttröpfchen erkennen, die im Wasser verteilt sind '''(Milch besteht aus Wasser und zum Beispiel 1,5 % Fett)'''</popup> |
| + | |||
| + | * <u>Lösungen von Salz oder Kohlendioxid in Wasser</u> | ||
<center> | <center> | ||
| − | <gallery> | + | <gallery heights=250 widths=250> |
File:90, Israel - panoramio.jpg|Nur am Rand sieht man, dass im Wasser des toten Meeres viel Salz gelöst ist. | File:90, Israel - panoramio.jpg|Nur am Rand sieht man, dass im Wasser des toten Meeres viel Salz gelöst ist. | ||
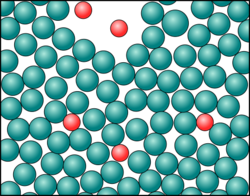
Teilchenmodell Lösung Salz.png|Die Ionen des Salzes sind im Wasser verteilt. | Teilchenmodell Lösung Salz.png|Die Ionen des Salzes sind im Wasser verteilt. | ||
| Zeile 43: | Zeile 46: | ||
</gallery> | </gallery> | ||
</center> | </center> | ||
| − | * <u>Wasser und Öl</u> | + | |
| + | <popup name="Lösung"><u>Lösungen von Salz oder Kohlendioxid in Wasser</u> sind '''homogene Gemische''', denen man kann nicht erkennenm dass das Waser nicht "rein" ist.</popup> | ||
| + | |||
| + | |||
| + | * <u>Wasser und Öl</u> | ||
<center> | <center> | ||
| − | <gallery> | + | <gallery heights=250 widths=250> |
Datei:Öl-Wasser-Gemisch.jpg|Das Öl hebt sich deutlich vom Wasser ab. | Datei:Öl-Wasser-Gemisch.jpg|Das Öl hebt sich deutlich vom Wasser ab. | ||
Datei:Teilchenmodell Emulsion.png|Auf Teilcheneben ist es wie bei Milch, nur sind die Öl-Tropfen größer. | Datei:Teilchenmodell Emulsion.png|Auf Teilcheneben ist es wie bei Milch, nur sind die Öl-Tropfen größer. | ||
| Zeile 51: | Zeile 58: | ||
</center> | </center> | ||
| + | <popup name="Lösung">Wasser und Öl vermischen sich nicht und man sieht zwei Phasen. Daher ergeben sie kein homogenes Gemisch.</popup> | ||
| − | {{AufgabeNr| | + | |
| + | {{Kurzregel|'''Eine Lösung im Teilchenmodell:''' Ein Stoff ist in einem Lösungsmittel löslich, wenn die Teilchen des Stoffes einzeln im Lösungsmittel verteilt ist, denn einzelne Teilchen kann man nicht sehen.}} | ||
| + | |||
| + | Damit sich die Teilchen des Stoffes im Lösungsmittel verteilen ... | ||
| + | * muss die Anziehung der Teilchen des Stoffes überwunden werden. | ||
| + | * die Teilchen des Lösungsmittel müssen die Stoff-Teilchen umgeben und dadurch von den anderen trennen. | ||
| + | |||
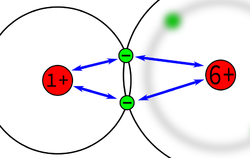
| + | Von Salz wissen wir, dass sich die Ionen, aufgrund der verschiedenen Ladungen sehr stark anziehen. Das Wassermoleküle haben allerdings hat den Vorteil, dass sie sich zu den Ionen hingezogen fühlen und dadurch sich eine stabile Schicht an Wasserteilchen rund um die Ionen bilden, die die Anziehung der Ionen untereinander aufhebt. | ||
| + | |||
| + | Daraus ergibt sich nun die Frage, warum Wasser das macht? Und warum lösen sich solche Stoffe wie Öl nicht in Wasser. Das können wir mit unserem bisherigen Wissen noch nicht erklären. Und darum soll es in diesem Themenabschnitt "Sauber und Schön" auch gehen. | ||
| + | |||
| + | Zum Abschluss der Wiederholung sollst du nun noch einmal die Begriffe zu den Gemisch-Typen üben und anwenden. | ||
| + | |||
| + | {{AufgabeNr|1a|2=Übe den Begriff und '''homogen''' und das Gegenteil '''heterogen''', indem du in einem Quiz jeweils bei einem Teilchenmodellbild entscheidest, ob man zwei Phasen erkennen kann oder nicht. | ||
: → [http://LearningApps.org/watch?v=phnso2gta17 Zuordnungs Quiz] | : → [http://LearningApps.org/watch?v=phnso2gta17 Zuordnungs Quiz] | ||
}} | }} | ||
| + | |||
| + | {{AufgabeNr|1b|2=Zur Wiederholung der Gemisch-Arten sortiere die Begriffe, die Aggregatzustände der Gemischbestandteile, das Teilchenmodell-Bild und ein Beispiel mit Beispiel-Bild. | ||
| + | |||
| + | Halte dann die Informationen in einer Tabelle fest (senkrecht/waagrecht die Aggregatzustände), wobei du in jedem Feld ein Beispiel für ein homogenes und ein Beispiel für ein heterogenes Gemisch notieren sollst. | ||
| + | : → [https://learningapps.org/watch?v=p9b3x40dn18 Zuordnungs-Tabelle] | ||
| + | }} | ||
| + | |||
=== Experimente zum Mischen von Öl und Wasser === | === Experimente zum Mischen von Öl und Wasser === | ||
'''Hinweis:''' Öl ist eine recht zähflüssige Flüssigkeit, was die Nutzung mit einigen Geräten recht unpraktisch macht. Daher wird bei einigen Experimenten das Öl durch etwas ersetzt, was sich wie Öl verhält, aber dünnflüssiger ist. | '''Hinweis:''' Öl ist eine recht zähflüssige Flüssigkeit, was die Nutzung mit einigen Geräten recht unpraktisch macht. Daher wird bei einigen Experimenten das Öl durch etwas ersetzt, was sich wie Öl verhält, aber dünnflüssiger ist. | ||
| − | |||
| − | |||
| − | '''Materialien:''' | + | {{AufgabeNr|2|Macht euch Notizen zu den Experimenten entsprechend der Anweisungen, die jeweils bei den einzelnen Experimenten zu finden sind. Es ist Hausaufgabe, dies ordentlich ins Heft zu notieren. Die Nummern der Experimente sind egal, wichtiger ist die Überschrift! |
| + | }} | ||
| + | |||
| + | |||
| + | {{Versuch+|'''1. Tröpfchen Wasser auf Öl und umgekehrt'''| | ||
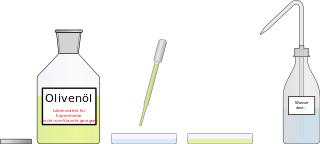
| + | '''Materialien:''' Spritzflasche mit Wasser, Flasche mit Öl und Pipette, zwei Petrischalen, Papier zum Reinigen der Petrischalen | ||
| + | |||
| + | '''Aufbau/Durchführung:''' In die Petrischalen wird einmal etwas von dem Olivenöl und einmal etwas Wasser gegeben, so dass die Schicht 1 cm hoch ist. Dann wird jeweils ein oder zwei Tropfen der anderen Flüssigkeit in die Petrischale gegeben. | ||
| + | |||
| + | <center>[[Datei:ZEICHNUNG EXPERIMENTWasser und Oel.svg|320px]]</center> | ||
| + | |||
| + | '''Aufgabe:''' Betrachtet genau, was mit dem Tropfen passiert. Skizziert es euch, wo der Tropfen ist, welche Form er nach kurzer Zeit hat usw. Beschreibt die Beobachtung mit Worten. | ||
| + | :Statt einer Skizze können auch Fotos gemacht werden, bei der man aber sehr gut den Unterschied sehen muss, damit es sich lohnt. Druckt euch dann die Bilder für euer Heft aus (angemessene Größe) und klebt sie zu euer wörtlichen Beschreibung. | ||
| − | ''' | + | '''Entsorgung:''' Beim Reinigen darf <u>kein Spülmittel</u> verwendet werden, da das die Experimente der nächsten Gruppen verfälschen! Die Inhalt der Gefäße werden einfach weggegossen und ein wenig mit Wasser ausgespült. Anschließend mit Papier trocken gerieben. |
}} | }} | ||
| − | |||
| − | |||
| − | '''Materialien:''' | + | {{Versuch+|'''2. Ablenkung durch den Luftballon?'''| |
| + | {{Sicherheitsinfo|GHSBrennbar|GHSGesundheitsgefahr|GHSReizend|GHSUmweltgefahr}} | ||
| + | '''Materialien:''' ''Das Experiment ist schon vorbereitet. Falls die Gruppe vor euch vergessen hat, die Flüssigkeiten zurück in die Büretten zu gießen, dann macht dies und nutzt die kleinen Trichter dazu, die auf den Bürtten bleiben sollen. Natürlich sollte der Hahn unten geschlossen sein ''(steht quer)''.'' Außerdem ein aufgeblasener Lauftballon. | ||
| − | '''Aufgabe:''' | + | '''Aufbau/Durchführung:''' Der Luftballon dient hier dazu, eine Ladung durch Reiben an einem Pulli/T-Shirt zu erzeugen. Das funktioniert am besten an Kunstfasern, geht aber auch mit Baumwoll-T-Shirts. Ob ihr eine Ladung habt, könnt ihr an frisch gewaschenen, nicht zu kurzen Haaren ausprobieren. |
| + | |||
| + | Nachdem der Ballon aufgeladen wurde öffnet ihr bei einer der Büretten unten den Hahn und lasst einen feinen Flüssigkeitesstrahl heraus. Dieser sollte zunächst in das jeweilige Becherglas gelangen! ''Lasst euch nicht zu viel Zeit, damit nicht die ganze Flüssigkeit herausgelaufen ist!'' Haltet dann den gerade erst aufgeladenen Ballon neben den Flüssigkeitsstrahl ohne ihn zu berühren. | ||
| + | |||
| + | |||
| + | <center>[[Datei:ZEICHNUNG EXPERIMENT Ablenkung von Wasserstrahl.svg|340px]]</center> | ||
| + | |||
| + | '''Aufgabe:''' Haltet in einer kurzen Skizze mit einer Beschreibung das Ergebnis des Experimentes unter der Überschrift "Ablenkung eines Wasserstrahls" im Heft fest. | ||
| + | |||
| + | '''Entsorgung:''' Die herausgelaufenen Flüssigkeiten werden wieder in die jeweiligen Büretten eingefüllt. Dazu könnt ihr die Büretten auf den Boden stellen, damit man leichter an die Öffnung kommt. Die Bechergläser müssen nicht gereinigt werden. Falls in der Bürette mit dem Wasser zu wenig Wasser enthalten ist, einfach mit Wasser aus dem Wasserhahn nachfüllen, indem ihr euch mit dem Becherglas etwas holt. Nutzt die Trichter, damit nichts daneben geht! | ||
}} | }} | ||
| − | |||
| − | |||
| − | '''Materialien:''' | + | {{Versuch+|'''3. Was ist in was löslich?'''| |
| + | {{Sicherheitsinfo|GHSBrennbar|GHSGesundheitsgefahr|GHSReizend|GHSUmweltgefahr}} | ||
| + | '''Materialien:''' Reagenzglasständer mit 6 Reagenzgläser, 6 Gummistopfen, wasserlöslicher Folienstift, Spritzflasche mit destlilliertem Wasser, 1-Pentanol, Heptan, Ethanol, Papier zum Reinigen der Stopfen | ||
| + | |||
| + | '''Aufbau/Durchführung:''' Ihr sollt untersuchen, wie gut sich die vier vorhandenen Chemikalien miteinander mischen. Diese 6 Mischversuche führt ihr in jeweils einem Reagenzglas durch. Beschriftet dazu die Reagenzgläser und haltet die verschiedenen Gemische darauf fest, damit ihr nicht den Überblick verliert. Gebt jeweils 1-2 cm der zwei Flüssigkeiten zusammen in das Reagenzglas, verschließt mit einem Stopfen und schüttelt ein wenig, um besser zu mischen. Lasst den Stopfen dann auf dem Reagenzglas und bereitet die nächste Mischung vor. | ||
| + | |||
| + | <center>[[Datei:ZEICHNUNG EXPERIMENT Mischversuche.svg|450px]]</center> | ||
| + | |||
| + | '''Aufgabe:''' Nachdem ihr alle Gemische hergestellt habt, haltet das Ergebnis unter der Überschrift "Mischversuche von Wasser mit verschiedenen Lösungsmitteln" fest, indem ihr eine Tabelle folgendermaßen anlegt. Notiert ein "+" , wenn die Stoffe sich miteinander so vermischen, dass man nur noch eine Phase sieht, notiert ein "-", wenn man sieht, dass sie sich nicht mischen lassen und sich zwei Phasen gebildet haben. | ||
| + | <center>[[Datei:Vorlage für Tabelle für Mischungsversuche.png|350px]]</center> | ||
| − | ''' | + | '''Entsorgung:''' Die Gemische werden in dem "Abfall-Becherglas" vorne am Lehrertisch gesammelt. Die Reagenzgläser werden nach dem Ausleeren in die Schüssel auf dem Lehrertisch eglegt, damit sie später gereinigt werden. Die Stopfen werden mit Papier abgewischt. |
}} | }} | ||
| − | |||
| − | |||
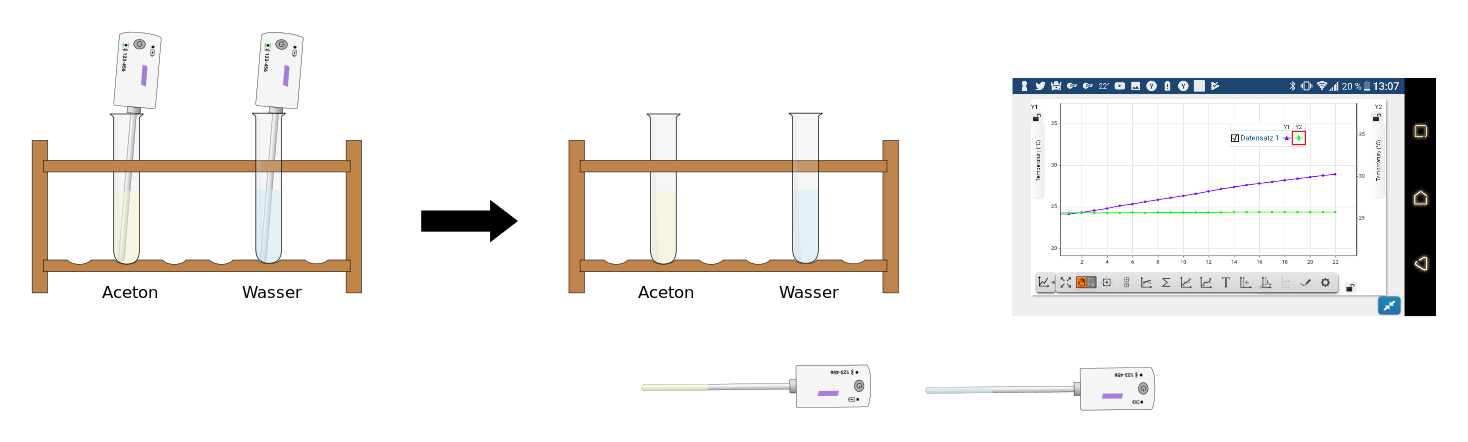
| − | ''' | + | {{Versuch+|'''4. Computer-Experiment: Vergleich der Verdungstungskälte von Aceton und Wasser'''| |
| + | '''Aufbau/Durchführung:''' Wenn ihr die Sensoren vorbereitet habt (siehe Aufgabe) schaut euch das Video '''→ [https://spark.adobe.com/video/PglkcY0FjDws1 hier]''' an, um du sehen, wie man mit zwei Sensoren im App '''SparkVue''' eine Messung durchführen und die Werte in einem Graph darstellen kann. | ||
| − | '''Aufgabe:''' | + | [[File:Vergleich der Verdunstungskaelte von Wasser und Aceton mit App.svg]] |
| + | |||
| + | '''Aufgabe:''' Stellt die Sensoren in die beiden Füüssigkeiten. Der Flüssigkeitsstand muss in beiden Reagenzgläser gleich hoch sein, damit die Sensoren gleich tief in den Flüssigkeiten stehen. Lasst die Sensoren in den Flüssigkeiten drin, solange ihr das Video anschaut. | ||
| + | |||
| + | Bereitet dann entsprechend der Anweisungen im Video die Messung vor, legt die Sensoren auf den Tisch (ohne sie abzuwischen) und startet sofort die Messung. | ||
| + | |||
| + | '''Entsorgung:''' Verschließt die Reagenzgläser, damit nichts verdunstet. Wischt die Sensoren mit Tüchern ab. | ||
}} | }} | ||
| + | |||
| + | |||
| + | |||
| + | {{Versuch+|'''5. Computer-Experiment: Simulation eines Wasser und Öl Gemisch'''| | ||
| + | '''Aufbau/Durchführung:''' Öffne das Programm "SimChemistry" am Schul-PC, lade dann hier diese ZIP-Datei herunter, entpacke sie und öffne in SimChemistry. | ||
| + | |||
| + | '''Aufgabe:''' Die blauen Teilchen sind die Wasser-Moleküle, sie haben fest definierte Eigenschaften. Die gelben Teilchen stehen für Teilchen von Öl oder anderen Lösungsmittel. Bei diesen Teilchen kannst du zwei Einstellungen vornehmen. | ||
| + | # Wie stark ziehen sich die gelben Teilchen untereinander an. | ||
| + | # Wie stark ziehen sich Wasser und Öl-Teilchen an. | ||
| + | Verändert die Einstellungen und wartet kurze Zeit, was sich verändert. Sucht verschiedene Einstellungen, bei denen sich die Teilchen mischen bzw. auftrennen. Skizziert dies im Heft und haltet dazu fest, welche Einstellungen vorliegen. | ||
| + | |||
| + | '''Entsorgung:''' Schließt das Fenster mit der von euch verwendeten Simulation. | ||
| + | }} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|3|Informiere dich über die Schmelz- und Siedetemperaturen der beteiligen Stoffe an den Experimenten. Halte die Werte in einer Tabelle fest. Dies wird später gebraucht. Vielleicht fällt dir aber schon etwas auf!?}} | ||
| + | |||
| + | |||
| + | <iframe scrolling="no" title="Vergleich von Siedetemperaturen verschiedener Lösungsmittel" src="https://www.geogebra.org/material/iframe/id/vXhe7KzC/width/983/height/492/border/888888/smb/false/stb/false/stbh/false/ai/false/asb/false/sri/true/rc/false/ld/false/sdz/false/ctl/false" width="983px" height="492px" style="border:0px;"> </iframe> | ||
| + | |||
| + | == Lösungsmittel unter der Lupe == | ||
| + | Öle sind recht komplizierte Verbindungen und haben große Moleküle. Sie zu beachten und zu verstehen, warum Wasser und Öl so unterschiedlich sind, lenkt von dem eigentlichen Problem ab. Wir beachten daher eine Gruppe von Verbindungen, die sich gut mit Öl vermischen und daher ähnliche Eigenschaften haben. Im Gegensatz zum sind die Moleküle aber recht einfach aufgebaut. | ||
| + | === Alkane - gesättigte Kohlenwasserstoff === | ||
| + | {{Kurzregel|'''Kohlenwasserstoffe''' sind Verbindungen, deren Moleküle nur aus Kohlenstoff- und Wasserstoffatomen bestehen. Der einfachste Vertreter ist das Methan.}} | ||
| + | |||
| + | {{Kurzregel|Als '''Alkane''' bezeichnet man '''Kohlenwasserstoffe''', bei denen sich die Atome immer nur jeweils ein Elektronenpaar teilen, dass sie zusammenhalten ('''Einfachbindung'''). Dagegen haben die Kohlenstoffatome bei '''Alkene''' auch mal vier gemeinsame Elektronen, sie haben '''Doppelbindungen'''. | ||
| + | |||
| + | <center> | ||
| + | <gallery caption = "Methan in verschiedenen Darstellungen"> | ||
| + | File:Kugelmodell Methan.png|Kugelmodell, wie die Atomehüllen überlappen | ||
| + | File:Methan Elektronenformel-Seite001.svg|Wie die Elektronenpaare zwischen den Atomen angeordnet sind | ||
| + | File:Methan Lewis.svg|Elektronenpaare als Striche gezeichnet ''(Lewisschreibweise)'' | ||
| + | </gallery> | ||
| + | </center> | ||
| + | |||
| + | <center> | ||
| + | <gallery caption = "Das einfachste Alken Ethen in verschiedenen Darstellungen"> | ||
| + | File:Kugelmodell Ethen.png|Kugelmodell, wie die Atomehüllen überlappen | ||
| + | File:Elektronenformel Punkte C2H4.svg|Wie die Elektronenpaare zwischen den Atomen angeordnet sind | ||
| + | File:Ethene Structural Formula V1.svg|Elektronenpaare als Striche gezeichnet ''(Lewisschreibweise)'' | ||
| + | </gallery> | ||
| + | |||
| + | </center> | ||
| + | |||
| + | }} | ||
| + | |||
| + | |||
| + | |||
| + | {{AufgabeNr|4|Informiere dich im Buch über die Alkane. Halte unter der Überschrift "Alkane" im Heft wichtige Informationen fest. Beachte dabei die '''Aufgabe 4''', damit du weißt, was du da machen musst. | ||
| + | {{Buch|Alkane|den Seiten 292-295}} | ||
| + | }} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|5| | ||
| + | 2=Halte im Heft unter der Überschrift '''Homologe Reihe Alkane''', die ersten 10 Alkane tabellarisch fest. Suche auch nach ihren Siedetemperaturen und halte sie in der letzten Spalte fest | ||
| + | |||
| + | Lerne die Namen und die Formeln auswendig. | ||
| + | |||
| + | :'''Tipp:''' Es gibt eine allgemeine Formel für Alkane C<sub>n</sub>H<sub>2n+2</sub>. | ||
| + | }} | ||
| + | |||
| + | {|class="wikitable" | ||
| + | |- | ||
| + | ! Namen !! Summenformeln !! Lewissschreibweise !! Siedetemperatur | ||
| + | |- | ||
| + | | Methan || <math>CH_4</math> || [[File:Methan Lewis.svg|80px]] || -161°C | ||
| + | |- | ||
| + | | Ethan || ... || ...|| ... | ||
| + | |- | ||
| + | | ... || ... || ...|| ... | ||
| + | |} | ||
| + | }}</center> | ||
| + | |||
| + | {{AufgabeNr|6|2=Übe die Namen und Formeln der ersten Alkane mit Hilfe der zwei Quizze: | ||
| + | * [http://LearningApps.org/watch?v=ppjhuwrkt17 Paare von Namen und Kugel-Stock-Modell zuordnen] | ||
| + | * [http://LearningApps.org/watch?v=psg8svb1j17 Ordne den Namen die Summenformeln und Lewisschreibweisen zu] | ||
| + | }} | ||
| + | |||
| + | === Verzweigt und verzwickt? === | ||
| + | Die Struktur ''(also wie die Atome aneinander hängen)'' bei den Alkanen scheint verhältnismäßig einfach und klar, aber ab 4 Kohlenstoffatomen taucht ein kleines Problem auf. Das sollst du mit Hilfe des Molekülbaukastens genauer erkunden. | ||
| + | |||
| + | {{Kurzregel|Ein '''Molekülbaukasten''' dient im Chemieunterricht zur Veranschaulichung von Molekülverbindungen. Die verschiedenen Atome werden dabei durch verschiedenfarbige Kunststoffkugeln dargestellt, die mit Hilfe von Verbindungsstücken zusammengestckt werden können.}} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|7|Baue mit dem Molekülbaukasten die folgenden einfachen Moleküle nach: | ||
| + | * C<sub>2</sub>H<sub>6</sub>, H<sub>2</sub>O, NH<sub>3</sub>, | ||
| + | }} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|8a|Schauen dir die Kugeln der folgenden Elemente einmal genauer an: | ||
| + | :: Kohlenstoff (schwarz), Sauerstoff (rot), Wasserstoff (weiß), Stickstoff (blau), Chlor (grün) | ||
| + | |||
| + | * Wenn nicht kaputt ''(was leider passieren kann, deshalb vorsichtig damit umgehen)'', hat jede Atomsorte eine bestimmte Anzahl an Steck-Anschlüssen. Halte dir die Anzahl in einer Tabelle fest. | ||
| + | * Nimm das Periodensystem an die Hand ''(Buch, kopierter Zettel, Wand)'' und suche nach Informationen zu der Elektronenverteilung, die die Anzahl an der Anschlüße erklären kann. | ||
| + | }} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|8b|In einer anderen Baukasten-Variante sind auch Schwefelatome enthalten. Vergleiche deine Ergebnisse aus Aufgabe 7a mit dem, was du beim Schwefelatom siehst. Wie ist das erklärbar?}} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|9|Nimm dir die zweimal die Atome, die du zum Bauen von Butan brauchst (also 4xC und 10xH mit entsprechenden Bindungen). | ||
| + | * Finde zwei Möglichkeiten, wie man diese 14 Atome unterschiedlichen zusammenbauen kann. | ||
| + | * Skizziere die zwei Möglichkeiten als Lewisschreibweise im Heft unter der Überschrift "Isomere von Butan"}} | ||
| + | |||
| + | == Was macht den Unterschied zwischen einem Wasser und einem Methan-Molekül? == | ||
| + | |||
| + | Wie wir schon bei den Siedetemperatur gesehen haben, hat Wasser im Vergleich zu Methan eine sehr viel höhere Temperatur, die sich nicht mit dem Gewicht erklären lässt. Die Experimente haben ja auch gezeigt, dass Wasser-Moleküle sich anziehen müssen. Ionen können allerdings nicht vorliegen, denn sonst wäre Wasser eher eine feste Verbindung. Woher die hohe Siedtemperatur kommt wollen wir nun erklären. | ||
| + | |||
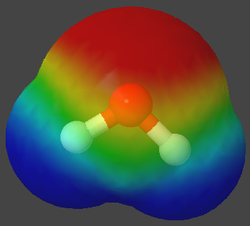
| + | Die folgenden Bilder zeigt spezielle Ansichten von einem Wasser- und einen Methan-Molekül. Dabei wird die Verteilung der Elektronen in den Hüllen der Atome angezeigt. Wobei mit den Farben gezeigt wird, ob ein relativer Elektronenmangel oder -überschuss herrscht. | ||
| + | |||
| + | <center><gallery widths=250px heights=250px> | ||
| + | Datei:CH4-MEP trans.png|Die Elektronen sind beim Methan so verteilt, dass es keinen Überschuß gibt. Das Molekül ist nach außen hin neutral. | ||
| + | Datei:H2O-MEP trans.png|Beim Wasser sieht man aufgrund der roten Farbe einen Elektronenüberschuss beim Sauertoffatom, dagegen bei den Wasserstoffatomen eine Mangel. | ||
| + | </gallery></center> | ||
| + | |||
| + | <u>Um es noch mal zu betonen:</u> hier hat keine echte Ionisierung stattgefunden! Durch eine ungleiche Verteilung der Elektronen | ||
| + | |||
| + | Um die Verteilung der Elektronen erklären zu können, wollen wir an einer Schalenmodelldarstellung vom Methan noch einmal erklären, wie die Atombindung zustande kommt. | ||
| + | |||
| + | <center><gallery widths=250px heights=250px> | ||
| + | Datei:Anziehung Elektron bei Atombindung bei Methan.png|Die äußersten Schalen des Kohlenstoffatoms überlappen mit den Schalen der Wasserstoffatome. Sie teilen sich so Elektronen, um den Edelgaszustand zu erreichen. | ||
| + | Datei:Detail Anziehung Elektron bei Atombindung bei Methan.png|Der Zusammenhalt kommt dadurch zustande, dass die Atomkerne die gemeinsamen Elektronen anziehen. | ||
| + | </gallery></center> | ||
| + | |||
| + | {{Kurzregel|Die '''Anziehung der Bindungselektronen''' ist bei den verschiedenen Atome unterschiedlich stark. Die Anziehung hängt ab von | ||
| + | * der Atomgröße | ||
| + | * der Ladung des Kerns.}} | ||
| + | |||
| + | Diese Anziehung kann man experimentell bestimmen und dass hat zu eine Liste von Zahlen geführt, den sogenannten Elektronegativitäten. | ||
| + | |||
| + | {{Kurzregel|Die '''Elektronegativität''' ist ein Maß für die Fähigkeit eines Atoms, die Bindungs-Elektronen an sich zu ziehen. | ||
| + | :''Üblicherweise findet man die Elektronegativitäten im Periodensystem, wie zum Beispiel hier, wo man auch ein [http://www.wolfenthal.de/drucken farbiges Periodensystems] herunterladen kann, um es sich auszudrucken.'' | ||
| + | }} | ||
| + | |||
| + | |||
| + | <center><iframe width="800px" height="450px" frameborder="no" scrolling="no" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true" src="https://lab.concord.org/embeddable.html#interactives/interactions/polarization.json"></iframe></center> | ||
| + | |||
| + | |||
| + | {| style="width:70em; text-align:center;" | ||
| + | |+ '''Allred-Rochow-Werte der Elektronegativität im Periodensystem der Elemente''' | ||
| + | |- | ||
| + | | Gruppe des Periodensystems|'''IUPAC-Gruppe''' | ||
| + | | Alkalimetalle|'''1''' || Erdalkalimetalle|'''2''' | ||
| + | | Scandiumgruppe|'''3''' | ||
| + | | Titangruppe|'''4''' || Vanadiumgruppe|'''5''' | ||
| + | | Chromgruppe|'''6''' | ||
| + | | Mangangruppe|'''7''' || Eisengruppe|'''8''' | ||
| + | | Cobaltgruppe|'''9''' | ||
| + | | Nickelgruppe|'''10''' || Kupfergruppe|'''11''' | ||
| + | | Zinkgruppe|'''12''' | ||
| + | | Borgruppe|'''13''' || Kohlenstoffgruppe|'''14''' | ||
| + | | Stickstoffgruppe|'''15''' | ||
| + | | Chalkogene|'''16''' || Halogene|'''17''' | ||
| + | | Edelgase|'''18''' | ||
| + | |- | ||
| + | | Periode des Periodensystems|'''Periode''' | ||
| + | | colspan="19" | | ||
| + | |- | ||
| + | | Chemische Elemente der ersten Periode|'''1''' | ||
| + | | bgcolor="#ff7e00" | H<br />2,20 | ||
| + | | colspan="16" | | ||
| + | | bgcolor="#e8e8e8" | He | ||
| + | |- | ||
| + | | Chemische Elemente der zweiten Periode|'''2''' | ||
| + | | bgcolor="#ffd900" | Li<br />0,97 | ||
| + | | bgcolor="#ffb600" | Be<br />1,47 | ||
| + | | colspan="10" | | ||
| + | | bgcolor="#ff8c00" | B<br />2,01 | ||
| + | | bgcolor="#ff6900" | C<br />2,50 | ||
| + | | bgcolor="#ff4600" | N<br />3,07 | ||
| + | | bgcolor="#ff2300" | O<br />3,50 | ||
| + | | bgcolor="#ff0000" | F<br />4,17 | ||
| + | | bgcolor="#e8e8e8" | Ne | ||
| + | |- | ||
| + | | Chemische Elemente der dritten Periode|'''3''' | ||
| + | | bgcolor="#ffd200" | Na<br />1,01 | ||
| + | | bgcolor="#ffc400" | Mg<br />1,23 | ||
| + | | colspan="10" | | ||
| + | | bgcolor="#ffb600" | Al<br />1,47 | ||
| + | | bgcolor="#ffa100" | Si<br />1,74 | ||
| + | | bgcolor="#ff8c00" | P<br />2,06 | ||
| + | | bgcolor="#ff7000" | S<br />2,44 | ||
| + | | bgcolor="#ff5400" | Cl<br />2,83 | ||
| + | | bgcolor="#e8e8e8" | Ar | ||
| + | |- | ||
| + | | Chemische Elemente der vierten Periode|'''4''' | ||
| + | | bgcolor="#ffd900" | K<br />0,91 | ||
| + | | bgcolor="#ffd200" | Ca<br />1,04 | ||
| + | | bgcolor="#ffc400" | Sc<br />1,20 | ||
| + | | bgcolor="#ffbd00" | Ti<br />1,32 | ||
| + | | bgcolor="#ffb600" | V<br />1,45 | ||
| + | | bgcolor="#ffaf00" | Cr<br />1,56 | ||
| + | | bgcolor="#ffa800" | Mn<br />1,60 | ||
| + | | bgcolor="#ffa800" | Fe<br />1,64 | ||
| + | | bgcolor="#ffa100" | Co<br />1,70 | ||
| + | | bgcolor="#ffa100" | Ni<br />1,75 | ||
| + | | bgcolor="#ffa100" | Cu<br />1,75 | ||
| + | | bgcolor="#ffa800" | Zn<br />1,66 | ||
| + | | bgcolor="#ff9a00" | Ga<br />1,82 | ||
| + | | bgcolor="#ff8c00" | Ge<br />2,02 | ||
| + | | bgcolor="#ff7e00" | As<br />2,20 | ||
| + | | bgcolor="#ff7000" | Se<br />2,48 | ||
| + | | bgcolor="#ff5400" | Br<br />2,74 | ||
| + | | bgcolor="#e8e8e8" | Kr | ||
| + | |- | ||
| + | | Chemische Elemente der fünften Periode|'''5''' | ||
| + | | bgcolor="#ffe000" | Rb<br />0,89 | ||
| + | | bgcolor="#ffd900" | Sr<br />0,99 | ||
| + | | bgcolor="#ffcc00" | Y<br />1,11 | ||
| + | | bgcolor="#ffc400" | Zr<br />1,22 | ||
| + | | bgcolor="#ffc400" | Nb<br />1,23 | ||
| + | | bgcolor="#ffbd00" | Mo<br />1,30 | ||
| + | | bgcolor="#ffbd00" | Tc<br />1,36 | ||
| + | | bgcolor="#ffb600" | Ru<br />1,42 | ||
| + | | bgcolor="#ffb600" | Rh<br />1,45 | ||
| + | | bgcolor="#ffbd00" | Pd<br />1,30 | ||
| + | | bgcolor="#ffb600" | Ag<br />1,42 | ||
| + | | bgcolor="#ffb600" | Cd<br />1,46 | ||
| + | | bgcolor="#ffb600" | In<br />1,49 | ||
| + | | bgcolor="#ffa100" | Sn<br />1,72 | ||
| + | | bgcolor="#ff9a00" | Sb<br />1,82 | ||
| + | | bgcolor="#ff8c00" | Te<br />2,01 | ||
| + | | bgcolor="#ff7e00" | I<br />2,21 | ||
| + | | bgcolor="#e8e8e8" | Xe | ||
| + | |- | ||
| + | | Chemische Elemente der sechsten Periode|'''6''' | ||
| + | | bgcolor="#ffe000" | Cs<br />0,86 | ||
| + | | bgcolor="#ffd900" | Ba<br />0,97 | ||
| + | | bgcolor="#ffcc00" | La<br />1,10 | ||
| + | | bgcolor="#ffc400" | Hf<br />1,23 | ||
| + | | bgcolor="#ffbd00" | Ta<br />1,33 | ||
| + | | bgcolor="#ffb600" | W<br />1,40 | ||
| + | | bgcolor="#ffb600" | Re<br />1,46 | ||
| + | | bgcolor="#ffaf00" | Os<br />1,52 | ||
| + | | bgcolor="#ffaf00" | Ir<br />1,55 | ||
| + | | bgcolor="#ffb600" | Pt<br />1,44 | ||
| + | | bgcolor="#ffb600" | Au<br />1,42 | ||
| + | | bgcolor="#ffb600" | Hg<br />1,44 | ||
| + | | bgcolor="#ffb600" | Tl<br />1,44 | ||
| + | | bgcolor="#ffaf00" | Pb<br />1,55 | ||
| + | | bgcolor="#ffa800" | Bi<br />1,67 | ||
| + | | bgcolor="#ffa100" | Po<br />1,76 | ||
| + | | bgcolor="#ff9300" | At<br />1,96 | ||
| + | | bgcolor="#e8e8e8" | Rn | ||
| + | |- | ||
| + | | Chemische Elemente der siebten Periode|'''7''' | ||
| + | | bgcolor="#ffe000" | Fr<br />0,86 | ||
| + | | bgcolor="#ffd900" | Ra<br />0,97 | ||
| + | | bgcolor="#e8e8e8" | Ac<br /> | ||
| + | | bgcolor="#e8e8e8" | Rf<br /> | ||
| + | | bgcolor="#e8e8e8" | Db<br /> | ||
| + | | bgcolor="#e8e8e8" | Sg<br /> | ||
| + | | bgcolor="#e8e8e8" | Bh<br /> | ||
| + | | bgcolor="#e8e8e8" | Hs<br /> | ||
| + | | bgcolor="#e8e8e8" | Mt<br /> | ||
| + | | bgcolor="#e8e8e8" | Ds<br /> | ||
| + | | bgcolor="#e8e8e8" | Rg<br /> | ||
| + | | bgcolor="#e8e8e8" | Cn<br /> | ||
| + | | bgcolor="#e8e8e8" | Nh<br /> | ||
| + | | bgcolor="#e8e8e8" | Fl<br /> | ||
| + | | bgcolor="#e8e8e8" | Mc<br /> | ||
| + | | bgcolor="#e8e8e8" | Lv<br /> | ||
| + | | bgcolor="#e8e8e8" | Ts<br /> | ||
| + | | bgcolor="#e8e8e8" | Og<br /> | ||
| + | |- | ||
| + | | colspan="20" | | ||
| + | |} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|10|2=Suche für die Atome, die beim Wasser und beim Methan vorkommen, die Elektronegativitätswerte heraus und notiere sie dir so: | ||
| + | :EN(H) = ... | ||
| + | :''... usw.'' | ||
| + | }} | ||
| + | |||
| + | {{AufgabeNr|10|2=Markiere hier bei dem Wasser- und bei dem Methanmolekül, zu welchen Kern die Bindungselektronen (''also die Striche zwischen den Atomen'') gezogen werden. Male dazu auf die Bindungsstriche Pfeile. | ||
| + | |||
| + | <center> [[File:H2O.svg|150px]] [[File:Methane-2D-square.png|150px]]</center>}} | ||
| + | <center> | ||
| + | <iframe width="800px" height="550px" frameborder="no" scrolling="no" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true" src="https://lab.concord.org/embeddable.html#interactives/interactions/elements-and-polarity.json"></iframe></center> | ||
| + | |||
| + | |||
| + | {{Kurzregel|Ein Dipol ...}} | ||
| + | |||
| + | == Gleiches löst sich in Gleichem == | ||
| + | |||
| + | |||
| + | <center>[[File:ZEICHNUNG Seifenmolekuele Aussehen.svg|500px]]</center> | ||
| + | |||
| + | |||
| + | <center>[[File:ZEICHNUNG Seifeloesung mit Micellen.svg|500px]]</center> | ||
| + | |||
| + | == Wasser ist etwas Besonderes! == | ||
| + | === Oberflächenspannung === | ||
| + | |||
| + | |||
| + | |||
| + | Betrachtet man die Siedetemperaturen von verschiedenen Wasserstoff-Verbindungen, so zeigt sich deutlich die Wirkung der Wasserstoffbrückenbindung und ihre Auswirkung auf die Werte. | ||
| + | <center>[[Datei:Siedetemperaturen mit H-Brücke.png|600px]]</center> | ||
| + | |||
| + | |||
| + | |||
| + | Eine kleine Amination, um die Wirkung der Wasserstoff-Brücken-Bindung zu zeigen: | ||
| + | <center> | ||
| + | {{#ev:youtube|NWAsuGSppyM|500}}</center> | ||
| + | |||
| + | |||
| + | |||
| + | <center>[[Datei:Anziehung Wasserteilchen.png]] [[File:WassermoleküleInTröpfchen-2.svg]]</center> | ||
| + | |||
| + | Weitere Bilder zur Oberflächenspannung: | ||
| + | |||
| + | <center>[[File:Surface tension March 2009-3.jpg|400px]] [[File:PotamogetonNatans2.jpg|500px]]</center> | ||
| + | |||
| + | |||
| + | [[File:Hg Mercury.jpg|thumb|Quecksilber-Tropfen]] | ||
| + | Übrigens gibt es noch einen Stoff, der eine höhere Oberflächenspannung hat als Wasser, nämlich Quecksilber. Man erkennt dies an den typischen runden Tröpfchen, die Quecksilber auch auf einem Untergrund ausbildet. | ||
| + | |||
| + | Dar Grund für die diese hohe Oberflächenspannung ist aber nicht eine Wasserstoffbrückenbindung. Vielmehr hat es damit zu tun, dass Quecksilber ein Metall ist. De Zusammenhalt der einzelnen Atome geschieht durch eine sogenannte Metallbindung, bei der sich quasi eine Kugelwolke um alle Atomkerne bildet. | ||
| + | |||
| + | |||
| + | Die Flash-Lerngeschichte {{Video}} [http://www.chemie-interaktiv.net/bilder/oberflaeche.swf Die Oberflächenspannung des Wassers] erläutert die Ursache der Oberflächen-Spannung noch einmal ausführlich. | ||
| + | |||
| + | === Dichteanomalie des Wassers === | ||
| + | |||
| + | Das Eis, also gefrorenes Wasser, auf flüssigem Wasser schwimmt, erscheint und normal. Tatsächlich ist Wasser da eine Ausnahme. Dazu ein Film: | ||
| + | |||
| + | <center>{{#ev:youtube|OfzbHz1e12E}} </center> | ||
| + | |||
| + | Man vergleicht im Film das Verhalten von Wasser, mit Wachs und Eisessig (99%iger Essig). Weil die Dichte von Eis geringer ist als die Dichte des umgebenden Wassers, kann es im Wasser schwimmen. Beim Wachs und beim Eisessig ist es anders. Die Dichte der beiden Feststoffe ist größer als die der entsprechenden Flüsigkeiten und deshalb gehen sie unter. | ||
| + | |||
| + | Wasser zeigt damit eine Besonderheit, wenn man die Dichte bei verschiedenen Temperaturen betrachtet. Eine Besonderheit, die es bei keinem anderen Stoff in der Art gibt. Üblicherweise ist es so, dass sich die Dichte eines Stoffes bei sinkender Temperatur erhöht. Grund dafür ist, dass die Teilchen bei sinkenden Temperaturen immer langsamer werden und dadurch näher zusammenrücken können. Da sich dabei das Volumen verringert, wird die Dichte größer, denn die Dichte wird ja berechnet durch | ||
| + | * <math>Dichte = \frac{Masse}{Volumen}</math> | ||
| + | |||
| + | <center>[[File:Teilchenmodell Gas.svg|350px]] [[File:Teilchenmodell Fluessigkeit.svg|350px]]</center> | ||
| + | |||
| + | Bei Wasser ist das nicht so. Es hat seine höchste Dichte bei 4°C. Dagegen ist die Dichte bei festem Wasser, also Eis, sehr viel geringer. Hexan zum Beispiel verhält sich "normal". Man erkennt, dass die Dichte sich mit der Temperatur kontinuierlich verändert: Je wärmer, desto kleiner wird die Dichte, denn bei einer schnelleren Bewegung brauchen die Teilchen mehr Platz, das Volumen vergrößert sich und so wird der Bruch kleiner. | ||
| + | |||
| + | {| | ||
| + | |- | ||
| + | |Die Tatsache, dass gefrorenes Wasser, also Eis, nicht absinkt ist von wesentlicher Bedeutung für das Überleben auf der Erde. Denn nur so können im Winter die Wasserbewohner überleben. Denn ist das Wasser tief genug, so friert ein Gewässer nicht durch und unten bildet sich eine 4°C kalte Schicht, in der die Wasserbewohner überleben können.||[[File:Anomalous expansion of water Summer Winter.svg]] | ||
| + | |} | ||
| + | |||
| + | Auch dieses Wasserphänomen lässt sich mit Hilfe der Wasserstoffbrücken erklären. Dazu der folgende Film, der den Übergang zwischen Wasser zu Eis dynamisch in Bewegung zeigt. | ||
| + | |||
| + | <center>{{#ev:youtube|bOPJ2_jb22E|550}} </center> | ||
| + | |||
| + | '''Erklärung:''' Beim Abkühlen bewegen sich die Wassermoleküle immer langsamer. Die relativ starke Wasserstoffbrücken-Bindung bewirkt die Anordnung der Moleküle in dem sechseckigen Wabengitter. Wird dagegen wieder erhitzt, so wird die Bewegung der Teilchen zu schnell, das Gitter zerfällt und die Wassermoleküle haben keinen festen Platz mehr. Sie sind enger beieinander und so hat das Wasser bei einer Temperatur knapp über dem Gefrierpunkt ein höhere Dichte (also kleineres Volumen). Beim Abkühlen nehmen die Wassermoleküle wieder von alleine die Position im Wabengitter ein. | ||
| + | |||
| + | Die zwei folgenden drehbaren Zeichnungen zeigen einmal Eis und zum anderen Wasser-Moleküle, die in Bewegung sind. | ||
| + | |||
| + | |||
| + | {| | ||
| + | |- | ||
| + | | | ||
| + | || || | ||
| + | |||
| + | Ein bewegliches Bild bekommst du auf der [[/Wassermoleküle geordnet/|Unterseite]] ''(denn leider kann die Extension zur Darstellung von 3D-Molekülen im Moment nur ein Bild pro Seite darstellen)''. | ||
| + | |||
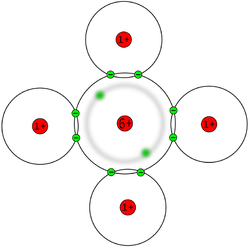
| + | '''Erklärungen:''' Man sieht eine recht große Anzahl an Wassermolekülen. Sie sind regelmäßig angeordnet, was sich daraus ergibt, dass je ein Wasserstoff-Atom mit einem der freien Elektronenpaare des Sauerstoff eines anderen Wassermoleküls über eine Wasserstoffbrücke miteinander "verbunden" sind. Diese starre Anordnung würde es aber in Realität nicht geben, da die Teilchen auch im gefrorenen Zustand immer ein wenig in Bewegung sind und auf der Stelle schwingen. Die Wasserstoffbrücken halten die Wassermoleküle aber trotzdem an der Stelle und bewirken die regelmäßige Anordnung. | ||
| + | |||
| + | Die Wasserstoffbrücken sind hier noch nicht zu sehen, so können aber sichtbar gemacht werden. | ||
| + | |||
| + | * Im Menü auf "Stil" dann auf "Wasserstoff(brücken)bindungen". Dort den Befehl "Berechnen" auswählen. Nun werden die Wasserstoffbrücken als gestrichelte Linien angezeigt. | ||
| + | |||
| + | Man hat eine Struktur, die von einigen Seiten sechseckige Löcher zeigt. Man also große Lücken, wodurch das Volumen größer und die Dichte geringer ist, als wenn die Moleküle beim flüssigen Wasser quasi lückenlos aneinander liegen. | ||
| + | |||
| + | '''WICHTIG:''' Die hier zu sehende Darstellung, dass die Moleküle einen großen Abstand voneinander haben, ist natürlich alles andere als realistisch. Die hier zu sehende sogenannte '''Kugel-Stab-Darstellung''' kann man so verstehen, dass die Kugeln für die Atomkerne stehen, die Stäbe für die Bindungen. Tatsächlich haben wir ja bei den Atombindungen eine Überlagerung der Atomhüllen. Dies wird besser in einer anderen Darstellung, dem sogenannten '''Kalottenmodell''' verdeutlicht. Ein einzelnes Wassermolekül sieht dann so aus, wie im Bild rechts. Die Wassermoleküle hier kann man auch alle im Kalottenmodell anzeigen lassen. [[File:H2o.png|right|80px|Kalottenmodell vom Wassermolekül]] | ||
| + | * Im Menü auf "Stil" dann auf "Schema". Dort wird die Einstellung "Kalotten" ausgewählt. Man kann die alte Ansicht wieder zurückholen, indem man an gleicher Stelle die Einstellung "Kugel-Stab" auswählt. | ||
| + | |||
| + | Nun sieht man, dass sich die Moleküle tatsächlich alle berühren. Man kann kaum zwischen der Bindung zwischen den Atomen und den Wasserstoffbrückenbindungen unterscheiden. Trotzdem sind immer noch Lücken vorhanden! | ||
| + | |||
| + | <small>[http://wikis.zum.de/chemie-digital/images/4/4a/Eis.cml Download der CML-Datei], um sie im Programm '''Avogadro''' genauer anschauen zu können.</small> | ||
| + | |- | ||
| + | | || | ||
| + | |- | ||
| + | |<jmol> | ||
| + | <jmolApplet> | ||
| + | <size>400</size> | ||
| + | <uploadedFileContents>Wasser-Cluster.cml</uploadedFileContents> | ||
| + | </jmolApplet> | ||
| + | </jmol> | ||
| + | || | ||
| + | || Hier ist auch wieder eine gewisse Anzahl an Wassermoleküle zu sehen und wie sie angeordnet wären, wenn das Wasser im flüssigen Zustand wäre. Es empfiehlt sich gleich, ins Kalottenmodell umzuschalten, damit man eine realistische Vorstellung hat. | ||
| + | |||
| + | Auch hier berühren sich die Moleküle und sieht man auch Lücken zwischen den einzelnen Molekülen, aber die Anordnung ist nicht regelmäßig und man kann nicht durchsehen. | ||
| + | |||
| + | Die Dichte ist in diesem Zustand höher als beim Eis, da weniger Lücken vorhanden sind. | ||
| + | |||
| + | <small>Die gleiche Zeichnung, bei der die Moleküle in Bewegung sind, ist [http://www.chemie.unibas.ch/study/ProTutLern/MolGal/html/cluster.html hier] zu sehen.</small> | ||
| + | |} | ||
| + | |||
| + | Eine weitere Darstellung für den Übergang zwischen Wasser und Eis wird auf [http://biomodel.uah.es/en/water/p3.htm dieser Seite] gezeigt. | ||
| + | |||
| + | {{Buch|Wasserstoffbrückenbindung und Dichteanomalie|den Seiten 221 und 222}} | ||
| + | |||
| + | [[Kategorie:Polarität]] | ||
| + | [[Kategorie:Löslichkeit]] | ||
| + | [[Kategorie:Rheinland-Pfalz]] | ||
| + | [[Kategorie:Dipol]] | ||
Aktuelle Version vom 4. Oktober 2020, 16:39 Uhr
- Waschmaschine Historisch.jpg
Alte Waschmachine, die nach dem gleichen Prinzip funktioniert wie heute
- Bundesarchiv Bild 102-09247, Berlinerin im Schaumbad.jpg
Welche Bedeutung das Reinigungsmittel, wie Seife?
- Gewerbewaschmaschine.jpg
Chemische Reinigung?
- Rednails.jpg
Sauber oder nicht? Schön ... ?
- Жидкость для снятия лака.JPG
Manchmal muss auch der Nagellack weg!
|
Eine Reinigung geschieht dadurch das
|
Tipps für die richtige Reinigung: Cleanipedia mit Reinigungstipps passend zu jedem Fleck!
Inhaltsverzeichnis |
Löslich oder nicht löslich?
Zwei Stoffe sind ineinander löslich, wenn beim Vermischen ein homogenes Gemisch entsteht.
|
Beispiele:
- Milch
- Milk glass.jpg
Von außen sieht man keine zwei Bestandteile
- Milkccar.jpg
... genauer betrachtet sieht man die Fetttröpfchen
- Lösungen von Salz oder Kohlendioxid in Wasser
- 90, Israel - panoramio.jpg
Nur am Rand sieht man, dass im Wasser des toten Meeres viel Salz gelöst ist.
- Drinking glass 00118.gif
Die Kohlensäurebläschen verlassen aus der Lösung heraus!
- Wasser und Öl
| Eine Lösung im Teilchenmodell: Ein Stoff ist in einem Lösungsmittel löslich, wenn die Teilchen des Stoffes einzeln im Lösungsmittel verteilt ist, denn einzelne Teilchen kann man nicht sehen. |
Damit sich die Teilchen des Stoffes im Lösungsmittel verteilen ...
- muss die Anziehung der Teilchen des Stoffes überwunden werden.
- die Teilchen des Lösungsmittel müssen die Stoff-Teilchen umgeben und dadurch von den anderen trennen.
Von Salz wissen wir, dass sich die Ionen, aufgrund der verschiedenen Ladungen sehr stark anziehen. Das Wassermoleküle haben allerdings hat den Vorteil, dass sie sich zu den Ionen hingezogen fühlen und dadurch sich eine stabile Schicht an Wasserteilchen rund um die Ionen bilden, die die Anziehung der Ionen untereinander aufhebt.
Daraus ergibt sich nun die Frage, warum Wasser das macht? Und warum lösen sich solche Stoffe wie Öl nicht in Wasser. Das können wir mit unserem bisherigen Wissen noch nicht erklären. Und darum soll es in diesem Themenabschnitt "Sauber und Schön" auch gehen.
Zum Abschluss der Wiederholung sollst du nun noch einmal die Begriffe zu den Gemisch-Typen üben und anwenden.
30px Aufgabe 1a
Übe den Begriff und homogen und das Gegenteil heterogen, indem du in einem Quiz jeweils bei einem Teilchenmodellbild entscheidest, ob man zwei Phasen erkennen kann oder nicht. |
30px Aufgabe 1b
Zur Wiederholung der Gemisch-Arten sortiere die Begriffe, die Aggregatzustände der Gemischbestandteile, das Teilchenmodell-Bild und ein Beispiel mit Beispiel-Bild. Halte dann die Informationen in einer Tabelle fest (senkrecht/waagrecht die Aggregatzustände), wobei du in jedem Feld ein Beispiel für ein homogenes und ein Beispiel für ein heterogenes Gemisch notieren sollst. |
Experimente zum Mischen von Öl und Wasser
Hinweis: Öl ist eine recht zähflüssige Flüssigkeit, was die Nutzung mit einigen Geräten recht unpraktisch macht. Daher wird bei einigen Experimenten das Öl durch etwas ersetzt, was sich wie Öl verhält, aber dünnflüssiger ist.
30px Aufgabe 2
Macht euch Notizen zu den Experimenten entsprechend der Anweisungen, die jeweils bei den einzelnen Experimenten zu finden sind. Es ist Hausaufgabe, dies ordentlich ins Heft zu notieren. Die Nummern der Experimente sind egal, wichtiger ist die Überschrift! |
VERSUCH: 2. Ablenkung durch den Luftballon?
Materialien: Das Experiment ist schon vorbereitet. Falls die Gruppe vor euch vergessen hat, die Flüssigkeiten zurück in die Büretten zu gießen, dann macht dies und nutzt die kleinen Trichter dazu, die auf den Bürtten bleiben sollen. Natürlich sollte der Hahn unten geschlossen sein (steht quer). Außerdem ein aufgeblasener Lauftballon. Aufbau/Durchführung: Der Luftballon dient hier dazu, eine Ladung durch Reiben an einem Pulli/T-Shirt zu erzeugen. Das funktioniert am besten an Kunstfasern, geht aber auch mit Baumwoll-T-Shirts. Ob ihr eine Ladung habt, könnt ihr an frisch gewaschenen, nicht zu kurzen Haaren ausprobieren. Nachdem der Ballon aufgeladen wurde öffnet ihr bei einer der Büretten unten den Hahn und lasst einen feinen Flüssigkeitesstrahl heraus. Dieser sollte zunächst in das jeweilige Becherglas gelangen! Lasst euch nicht zu viel Zeit, damit nicht die ganze Flüssigkeit herausgelaufen ist! Haltet dann den gerade erst aufgeladenen Ballon neben den Flüssigkeitsstrahl ohne ihn zu berühren.
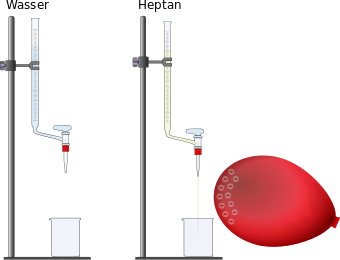 Aufgabe: Haltet in einer kurzen Skizze mit einer Beschreibung das Ergebnis des Experimentes unter der Überschrift "Ablenkung eines Wasserstrahls" im Heft fest. Entsorgung: Die herausgelaufenen Flüssigkeiten werden wieder in die jeweiligen Büretten eingefüllt. Dazu könnt ihr die Büretten auf den Boden stellen, damit man leichter an die Öffnung kommt. Die Bechergläser müssen nicht gereinigt werden. Falls in der Bürette mit dem Wasser zu wenig Wasser enthalten ist, einfach mit Wasser aus dem Wasserhahn nachfüllen, indem ihr euch mit dem Becherglas etwas holt. Nutzt die Trichter, damit nichts daneben geht! |
VERSUCH: 3. Was ist in was löslich?
Materialien: Reagenzglasständer mit 6 Reagenzgläser, 6 Gummistopfen, wasserlöslicher Folienstift, Spritzflasche mit destlilliertem Wasser, 1-Pentanol, Heptan, Ethanol, Papier zum Reinigen der Stopfen Aufbau/Durchführung: Ihr sollt untersuchen, wie gut sich die vier vorhandenen Chemikalien miteinander mischen. Diese 6 Mischversuche führt ihr in jeweils einem Reagenzglas durch. Beschriftet dazu die Reagenzgläser und haltet die verschiedenen Gemische darauf fest, damit ihr nicht den Überblick verliert. Gebt jeweils 1-2 cm der zwei Flüssigkeiten zusammen in das Reagenzglas, verschließt mit einem Stopfen und schüttelt ein wenig, um besser zu mischen. Lasst den Stopfen dann auf dem Reagenzglas und bereitet die nächste Mischung vor. 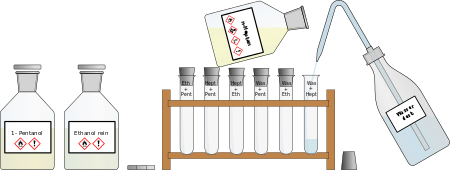 Aufgabe: Nachdem ihr alle Gemische hergestellt habt, haltet das Ergebnis unter der Überschrift "Mischversuche von Wasser mit verschiedenen Lösungsmitteln" fest, indem ihr eine Tabelle folgendermaßen anlegt. Notiert ein "+" , wenn die Stoffe sich miteinander so vermischen, dass man nur noch eine Phase sieht, notiert ein "-", wenn man sieht, dass sie sich nicht mischen lassen und sich zwei Phasen gebildet haben. 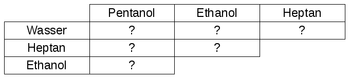 Entsorgung: Die Gemische werden in dem "Abfall-Becherglas" vorne am Lehrertisch gesammelt. Die Reagenzgläser werden nach dem Ausleeren in die Schüssel auf dem Lehrertisch eglegt, damit sie später gereinigt werden. Die Stopfen werden mit Papier abgewischt. |
| VERSUCH: 4. Computer-Experiment: Vergleich der Verdungstungskälte von Aceton und Wasser
Aufbau/Durchführung: Wenn ihr die Sensoren vorbereitet habt (siehe Aufgabe) schaut euch das Video → hier an, um du sehen, wie man mit zwei Sensoren im App SparkVue eine Messung durchführen und die Werte in einem Graph darstellen kann. Aufgabe: Stellt die Sensoren in die beiden Füüssigkeiten. Der Flüssigkeitsstand muss in beiden Reagenzgläser gleich hoch sein, damit die Sensoren gleich tief in den Flüssigkeiten stehen. Lasst die Sensoren in den Flüssigkeiten drin, solange ihr das Video anschaut. Bereitet dann entsprechend der Anweisungen im Video die Messung vor, legt die Sensoren auf den Tisch (ohne sie abzuwischen) und startet sofort die Messung. Entsorgung: Verschließt die Reagenzgläser, damit nichts verdunstet. Wischt die Sensoren mit Tüchern ab. |
| VERSUCH: 5. Computer-Experiment: Simulation eines Wasser und Öl Gemisch
Aufbau/Durchführung: Öffne das Programm "SimChemistry" am Schul-PC, lade dann hier diese ZIP-Datei herunter, entpacke sie und öffne in SimChemistry. Aufgabe: Die blauen Teilchen sind die Wasser-Moleküle, sie haben fest definierte Eigenschaften. Die gelben Teilchen stehen für Teilchen von Öl oder anderen Lösungsmittel. Bei diesen Teilchen kannst du zwei Einstellungen vornehmen.
Verändert die Einstellungen und wartet kurze Zeit, was sich verändert. Sucht verschiedene Einstellungen, bei denen sich die Teilchen mischen bzw. auftrennen. Skizziert dies im Heft und haltet dazu fest, welche Einstellungen vorliegen. Entsorgung: Schließt das Fenster mit der von euch verwendeten Simulation. |
30px Aufgabe 3
Informiere dich über die Schmelz- und Siedetemperaturen der beteiligen Stoffe an den Experimenten. Halte die Werte in einer Tabelle fest. Dies wird später gebraucht. Vielleicht fällt dir aber schon etwas auf!? |
Lösungsmittel unter der Lupe
Öle sind recht komplizierte Verbindungen und haben große Moleküle. Sie zu beachten und zu verstehen, warum Wasser und Öl so unterschiedlich sind, lenkt von dem eigentlichen Problem ab. Wir beachten daher eine Gruppe von Verbindungen, die sich gut mit Öl vermischen und daher ähnliche Eigenschaften haben. Im Gegensatz zum sind die Moleküle aber recht einfach aufgebaut.
Alkane - gesättigte Kohlenwasserstoff
| Kohlenwasserstoffe sind Verbindungen, deren Moleküle nur aus Kohlenstoff- und Wasserstoffatomen bestehen. Der einfachste Vertreter ist das Methan. |
Als Alkane bezeichnet man Kohlenwasserstoffe, bei denen sich die Atome immer nur jeweils ein Elektronenpaar teilen, dass sie zusammenhalten (Einfachbindung). Dagegen haben die Kohlenstoffatome bei Alkene auch mal vier gemeinsame Elektronen, sie haben Doppelbindungen.
|
30px Aufgabe 4
Informiere dich im Buch über die Alkane. Halte unter der Überschrift "Alkane" im Heft wichtige Informationen fest. Beachte dabei die Aufgabe 4, damit du weißt, was du da machen musst.
|
30px Aufgabe 5
Halte im Heft unter der Überschrift Homologe Reihe Alkane, die ersten 10 Alkane tabellarisch fest. Suche auch nach ihren Siedetemperaturen und halte sie in der letzten Spalte fest Lerne die Namen und die Formeln auswendig.
|
| Namen | Summenformeln | Lewissschreibweise | Siedetemperatur |
|---|---|---|---|
| Methan | 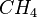 |
80px | -161°C |
| Ethan | ... | ... | ... |
| ... | ... | ... | ... |
}}</center>
30px Aufgabe 6
Übe die Namen und Formeln der ersten Alkane mit Hilfe der zwei Quizze: |
Verzweigt und verzwickt?
Die Struktur (also wie die Atome aneinander hängen) bei den Alkanen scheint verhältnismäßig einfach und klar, aber ab 4 Kohlenstoffatomen taucht ein kleines Problem auf. Das sollst du mit Hilfe des Molekülbaukastens genauer erkunden.
| Ein Molekülbaukasten dient im Chemieunterricht zur Veranschaulichung von Molekülverbindungen. Die verschiedenen Atome werden dabei durch verschiedenfarbige Kunststoffkugeln dargestellt, die mit Hilfe von Verbindungsstücken zusammengestckt werden können. |
30px Aufgabe 7
Baue mit dem Molekülbaukasten die folgenden einfachen Moleküle nach:
|
30px Aufgabe 8a
Schauen dir die Kugeln der folgenden Elemente einmal genauer an:
|
30px Aufgabe 8b
In einer anderen Baukasten-Variante sind auch Schwefelatome enthalten. Vergleiche deine Ergebnisse aus Aufgabe 7a mit dem, was du beim Schwefelatom siehst. Wie ist das erklärbar? |
30px Aufgabe 9
Nimm dir die zweimal die Atome, die du zum Bauen von Butan brauchst (also 4xC und 10xH mit entsprechenden Bindungen).
|
Was macht den Unterschied zwischen einem Wasser und einem Methan-Molekül?
Wie wir schon bei den Siedetemperatur gesehen haben, hat Wasser im Vergleich zu Methan eine sehr viel höhere Temperatur, die sich nicht mit dem Gewicht erklären lässt. Die Experimente haben ja auch gezeigt, dass Wasser-Moleküle sich anziehen müssen. Ionen können allerdings nicht vorliegen, denn sonst wäre Wasser eher eine feste Verbindung. Woher die hohe Siedtemperatur kommt wollen wir nun erklären.
Die folgenden Bilder zeigt spezielle Ansichten von einem Wasser- und einen Methan-Molekül. Dabei wird die Verteilung der Elektronen in den Hüllen der Atome angezeigt. Wobei mit den Farben gezeigt wird, ob ein relativer Elektronenmangel oder -überschuss herrscht.
Um es noch mal zu betonen: hier hat keine echte Ionisierung stattgefunden! Durch eine ungleiche Verteilung der Elektronen
Um die Verteilung der Elektronen erklären zu können, wollen wir an einer Schalenmodelldarstellung vom Methan noch einmal erklären, wie die Atombindung zustande kommt.
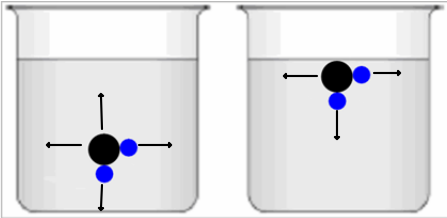
Die Anziehung der Bindungselektronen ist bei den verschiedenen Atome unterschiedlich stark. Die Anziehung hängt ab von
|
Diese Anziehung kann man experimentell bestimmen und dass hat zu eine Liste von Zahlen geführt, den sogenannten Elektronegativitäten.
Die Elektronegativität ist ein Maß für die Fähigkeit eines Atoms, die Bindungs-Elektronen an sich zu ziehen.
|
| IUPAC-Gruppe | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Periode | |||||||||||||||||||
| 1 | H 2,20 |
He | |||||||||||||||||
| 2 | Li 0,97 |
Be 1,47 |
B 2,01 |
C 2,50 |
N 3,07 |
O 3,50 |
F 4,17 |
Ne | |||||||||||
| 3 | Na 1,01 |
Mg 1,23 |
Al 1,47 |
Si 1,74 |
P 2,06 |
S 2,44 |
Cl 2,83 |
Ar | |||||||||||
| 4 | K 0,91 |
Ca 1,04 |
Sc 1,20 |
Ti 1,32 |
V 1,45 |
Cr 1,56 |
Mn 1,60 |
Fe 1,64 |
Co 1,70 |
Ni 1,75 |
Cu 1,75 |
Zn 1,66 |
Ga 1,82 |
Ge 2,02 |
As 2,20 |
Se 2,48 |
Br 2,74 |
Kr | |
| 5 | Rb 0,89 |
Sr 0,99 |
Y 1,11 |
Zr 1,22 |
Nb 1,23 |
Mo 1,30 |
Tc 1,36 |
Ru 1,42 |
Rh 1,45 |
Pd 1,30 |
Ag 1,42 |
Cd 1,46 |
In 1,49 |
Sn 1,72 |
Sb 1,82 |
Te 2,01 |
I 2,21 |
Xe | |
| 6 | Cs 0,86 |
Ba 0,97 |
La 1,10 |
Hf 1,23 |
Ta 1,33 |
W 1,40 |
Re 1,46 |
Os 1,52 |
Ir 1,55 |
Pt 1,44 |
Au 1,42 |
Hg 1,44 |
Tl 1,44 |
Pb 1,55 |
Bi 1,67 |
Po 1,76 |
At 1,96 |
Rn | |
| 7 | Fr 0,86 |
Ra 0,97 |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og | |
30px Aufgabe 10
Suche für die Atome, die beim Wasser und beim Methan vorkommen, die Elektronegativitätswerte heraus und notiere sie dir so:
|
30px Aufgabe 10
Markiere hier bei dem Wasser- und bei dem Methanmolekül, zu welchen Kern die Bindungselektronen (also die Striche zwischen den Atomen) gezogen werden. Male dazu auf die Bindungsstriche Pfeile. |
| Ein Dipol ... |
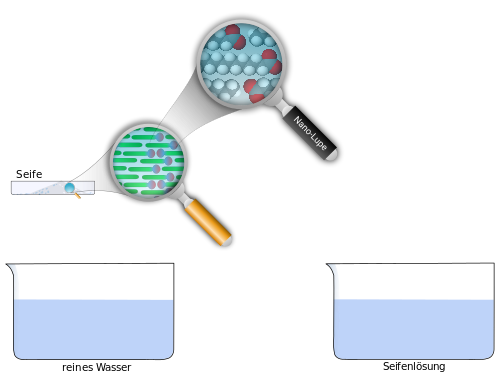
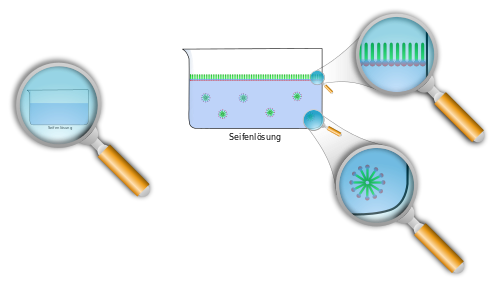
Gleiches löst sich in Gleichem
Wasser ist etwas Besonderes!
Oberflächenspannung
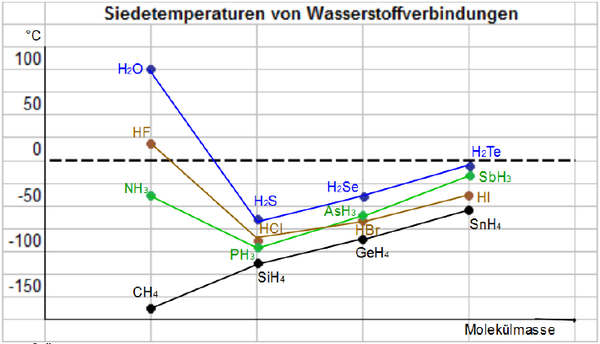
Betrachtet man die Siedetemperaturen von verschiedenen Wasserstoff-Verbindungen, so zeigt sich deutlich die Wirkung der Wasserstoffbrückenbindung und ihre Auswirkung auf die Werte.
Eine kleine Amination, um die Wirkung der Wasserstoff-Brücken-Bindung zu zeigen:
 Datei:WassermoleküleInTröpfchen-2.svg
Datei:WassermoleküleInTröpfchen-2.svgWeitere Bilder zur Oberflächenspannung:
Übrigens gibt es noch einen Stoff, der eine höhere Oberflächenspannung hat als Wasser, nämlich Quecksilber. Man erkennt dies an den typischen runden Tröpfchen, die Quecksilber auch auf einem Untergrund ausbildet.
Dar Grund für die diese hohe Oberflächenspannung ist aber nicht eine Wasserstoffbrückenbindung. Vielmehr hat es damit zu tun, dass Quecksilber ein Metall ist. De Zusammenhalt der einzelnen Atome geschieht durch eine sogenannte Metallbindung, bei der sich quasi eine Kugelwolke um alle Atomkerne bildet.
Die Flash-Lerngeschichte 15px Die Oberflächenspannung des Wassers erläutert die Ursache der Oberflächen-Spannung noch einmal ausführlich.
Dichteanomalie des Wassers
Das Eis, also gefrorenes Wasser, auf flüssigem Wasser schwimmt, erscheint und normal. Tatsächlich ist Wasser da eine Ausnahme. Dazu ein Film:
Man vergleicht im Film das Verhalten von Wasser, mit Wachs und Eisessig (99%iger Essig). Weil die Dichte von Eis geringer ist als die Dichte des umgebenden Wassers, kann es im Wasser schwimmen. Beim Wachs und beim Eisessig ist es anders. Die Dichte der beiden Feststoffe ist größer als die der entsprechenden Flüsigkeiten und deshalb gehen sie unter.
Wasser zeigt damit eine Besonderheit, wenn man die Dichte bei verschiedenen Temperaturen betrachtet. Eine Besonderheit, die es bei keinem anderen Stoff in der Art gibt. Üblicherweise ist es so, dass sich die Dichte eines Stoffes bei sinkender Temperatur erhöht. Grund dafür ist, dass die Teilchen bei sinkenden Temperaturen immer langsamer werden und dadurch näher zusammenrücken können. Da sich dabei das Volumen verringert, wird die Dichte größer, denn die Dichte wird ja berechnet durch
Bei Wasser ist das nicht so. Es hat seine höchste Dichte bei 4°C. Dagegen ist die Dichte bei festem Wasser, also Eis, sehr viel geringer. Hexan zum Beispiel verhält sich "normal". Man erkennt, dass die Dichte sich mit der Temperatur kontinuierlich verändert: Je wärmer, desto kleiner wird die Dichte, denn bei einer schnelleren Bewegung brauchen die Teilchen mehr Platz, das Volumen vergrößert sich und so wird der Bruch kleiner.
| Die Tatsache, dass gefrorenes Wasser, also Eis, nicht absinkt ist von wesentlicher Bedeutung für das Überleben auf der Erde. Denn nur so können im Winter die Wasserbewohner überleben. Denn ist das Wasser tief genug, so friert ein Gewässer nicht durch und unten bildet sich eine 4°C kalte Schicht, in der die Wasserbewohner überleben können. | Datei:Anomalous expansion of water Summer Winter.svg |
Auch dieses Wasserphänomen lässt sich mit Hilfe der Wasserstoffbrücken erklären. Dazu der folgende Film, der den Übergang zwischen Wasser zu Eis dynamisch in Bewegung zeigt.
Erklärung: Beim Abkühlen bewegen sich die Wassermoleküle immer langsamer. Die relativ starke Wasserstoffbrücken-Bindung bewirkt die Anordnung der Moleküle in dem sechseckigen Wabengitter. Wird dagegen wieder erhitzt, so wird die Bewegung der Teilchen zu schnell, das Gitter zerfällt und die Wassermoleküle haben keinen festen Platz mehr. Sie sind enger beieinander und so hat das Wasser bei einer Temperatur knapp über dem Gefrierpunkt ein höhere Dichte (also kleineres Volumen). Beim Abkühlen nehmen die Wassermoleküle wieder von alleine die Position im Wabengitter ein.
Die zwei folgenden drehbaren Zeichnungen zeigen einmal Eis und zum anderen Wasser-Moleküle, die in Bewegung sind.
|
Ein bewegliches Bild bekommst du auf der Unterseite (denn leider kann die Extension zur Darstellung von 3D-Molekülen im Moment nur ein Bild pro Seite darstellen). Erklärungen: Man sieht eine recht große Anzahl an Wassermolekülen. Sie sind regelmäßig angeordnet, was sich daraus ergibt, dass je ein Wasserstoff-Atom mit einem der freien Elektronenpaare des Sauerstoff eines anderen Wassermoleküls über eine Wasserstoffbrücke miteinander "verbunden" sind. Diese starre Anordnung würde es aber in Realität nicht geben, da die Teilchen auch im gefrorenen Zustand immer ein wenig in Bewegung sind und auf der Stelle schwingen. Die Wasserstoffbrücken halten die Wassermoleküle aber trotzdem an der Stelle und bewirken die regelmäßige Anordnung. Die Wasserstoffbrücken sind hier noch nicht zu sehen, so können aber sichtbar gemacht werden.
Man hat eine Struktur, die von einigen Seiten sechseckige Löcher zeigt. Man also große Lücken, wodurch das Volumen größer und die Dichte geringer ist, als wenn die Moleküle beim flüssigen Wasser quasi lückenlos aneinander liegen. WICHTIG: Die hier zu sehende Darstellung, dass die Moleküle einen großen Abstand voneinander haben, ist natürlich alles andere als realistisch. Die hier zu sehende sogenannte Kugel-Stab-Darstellung kann man so verstehen, dass die Kugeln für die Atomkerne stehen, die Stäbe für die Bindungen. Tatsächlich haben wir ja bei den Atombindungen eine Überlagerung der Atomhüllen. Dies wird besser in einer anderen Darstellung, dem sogenannten Kalottenmodell verdeutlicht. Ein einzelnes Wassermolekül sieht dann so aus, wie im Bild rechts. Die Wassermoleküle hier kann man auch alle im Kalottenmodell anzeigen lassen.
Nun sieht man, dass sich die Moleküle tatsächlich alle berühren. Man kann kaum zwischen der Bindung zwischen den Atomen und den Wasserstoffbrückenbindungen unterscheiden. Trotzdem sind immer noch Lücken vorhanden! Download der CML-Datei, um sie im Programm Avogadro genauer anschauen zu können. | ||
| Hier ist auch wieder eine gewisse Anzahl an Wassermoleküle zu sehen und wie sie angeordnet wären, wenn das Wasser im flüssigen Zustand wäre. Es empfiehlt sich gleich, ins Kalottenmodell umzuschalten, damit man eine realistische Vorstellung hat.
Auch hier berühren sich die Moleküle und sieht man auch Lücken zwischen den einzelnen Molekülen, aber die Anordnung ist nicht regelmäßig und man kann nicht durchsehen. Die Dichte ist in diesem Zustand höher als beim Eis, da weniger Lücken vorhanden sind. Die gleiche Zeichnung, bei der die Moleküle in Bewegung sind, ist hier zu sehen. |
Eine weitere Darstellung für den Übergang zwischen Wasser und Eis wird auf dieser Seite gezeigt.
| 50px | Im Buch zu lesen: Zum Thema Wasserstoffbrückenbindung und Dichteanomalie findest du in unserem Buch Informationen auf den Seiten 221 und 222. |