Von der Saline zum Kochsalz: Unterschied zwischen den Versionen
(→Eigenschaften von Salz untersuchen) |
(→Eigenschaften von Salz untersuchen) |
||
| Zeile 90: | Zeile 90: | ||
| − | {{Versuche|1=<big><span style="background:#BDBDBD"> Station Grau (am Lehrertisch) </span></big> '''<u>Frage:</u> Was passiert beim Zerbrechen von Kristallen''' | + | {{Versuche|1= <big><span style="background:#BDBDBD"> Station Grau (am Lehrertisch) </span></big> '''<u>Frage:</u> Was passiert beim Zerbrechen von Kristallen''' |
'''Aufbau/Durchführung:''' Versuche vorsichtig, die Kristalle zu zerspalten. | '''Aufbau/Durchführung:''' Versuche vorsichtig, die Kristalle zu zerspalten. | ||
| Zeile 101: | Zeile 101: | ||
| − | {{Versuche|1=<big><span style="background:#FF0000"> Station Rot </span></big> '''<u>Frage:</u> Wie verhält sich Eis beim Schmelzen, wenn Kochsalz zugegeben wird?''' | + | {{Versuche|1= <big><span style="background:#FF0000"> Station Rot </span></big> '''<u>Frage:</u> Wie verhält sich Eis beim Schmelzen, wenn Kochsalz zugegeben wird?''' |
'''Aufbau/Durchführung:''' | '''Aufbau/Durchführung:''' | ||
| Zeile 113: | Zeile 113: | ||
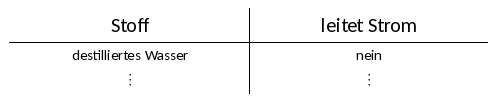
| − | {{Versuche|1=<big><span style="background:#0000FF"> Station Blau </span></big> '''<u>Frage:</u> Wie verhält sich Kochsalz und eine Kochsalzlösung gegenüber dem elektrischen Strom? Vergleiche auch mit reiner Wasserlösung, einem Zuckerkristall und Zuckerlösung.''' | + | {{Versuche|1= <big><span style="background:#0000FF"> Station Blau </span></big> '''<u>Frage:</u> Wie verhält sich Kochsalz und eine Kochsalzlösung gegenüber dem elektrischen Strom? Vergleiche auch mit reiner Wasserlösung, einem Zuckerkristall und Zuckerlösung.''' |
'''Aufbau/Durchführung:''' | '''Aufbau/Durchführung:''' | ||
| Zeile 132: | Zeile 132: | ||
| − | {{Versuche|1= | + | {{Versuche|1={{Sicherheitsinfo|Schutzbrille}} <big><span style="background:#8904B1"> Station Lila </span></big> '''<u>Frage:</u> Wie verhält sich Kochsalz beim Erhitzen im Vergleich zu Zucker.''' |
<center>'''Achtung! Nicht das Reagenzglas nach dem Erhitzen berühren; Verbrennungsgefahr!'''</center> | <center>'''Achtung! Nicht das Reagenzglas nach dem Erhitzen berühren; Verbrennungsgefahr!'''</center> | ||
Version vom 16. Mai 2016, 22:06 Uhr
Inhaltsverzeichnis[Verbergen] |
Salz - ein alltäglicher Stoff
- FOLIEN-Quiz - Gesucht ist der Stoff X
| Das, was man umgangssprachlich als Salz bezeichnet, nennt der Chemiker Natriumchlorid.
Salz ist eine Bezeichnung für eine Gruppe von chemischen Stoffen, die alle sehr ähnliche Eigenschaften haben. Das Natriumchlorid, auch Kochsalz genannt, ist dabei in typischer Vertreter. |
- VIDEO - Nicht nur Geschmackssache (nur bis min. anschauen, da dann der Film sich dann mehr auf den industriellen Einsatz beschäftigt, der uns im Moment nicht so sehr beschäftigt!).
|
Auf diesem Arbeitsblatt findet du einige Informationen, über Salz (Kochsalz) und wie es sich im Körper auswirkt. Lies dir die Informationen durch und markiere wichtige Informationen. |
- Beispiele für die Anwendung von Kochsalz/Natriumchlorid
Gewinnung von Salz
Salz kommt als Mineral an verschiedenen Stellen der Erde vor. Das Vorkommen bestimmt, wie man es abaut und für die Verwendungs als Speise- oder Industriesalz gewinnt.
Als Steinsalz, bezeichnet man ein Sedimentgestein, welches in der geologischen Vergangenheit Erde auf natürlichem Weg durch Ausfällung aus konzentriertem Meerwasser entstanden ist und nun in Bergwerken abgebaut wird.
Große Mengen an Salz sind auch im Meerwasser vorhanden. Es ist chemisch gesehen eine Lösung, von Natriumchlorid in Wasser (und in kleineren Mengen einigen anderen Salzen) die einen durchschnittlichen Salzgehalt von 3,5% Massenanteil hat. Der Gesamtsalzgehalt schwankt je nach Meer. Die Ostsee hat einen Salzgehalt von 0,2 bis 2%. Einige Binnenseen ohne Abfluss haben weit höhere Salzanteile im Wasser; das Tote Meer ist für seinen Salzgehalt von 28% bekannt.
|
Gewinnung Salz aus dem Meerwasser Schaut euch Eventuell ist es sinnvoll, den Film zweimal anzuschauen. Beim ersten Mal um einen Überblick zu bekommen und das zweite Mal, um das Schema auszufüllen. |
ACHTUNG: Notiere dir die Menge an eingesetztem Steinsalz und bestimme die Menge an Kochsalz, die du daraus gewinnst. Diese Werte werden für die Aufgabe 3b benötigt! |
Verwende für die folgenden Aufgaben den von dir berechneten Wert:
|
Eigenschaften von Salz untersuchen
Du sollst die Eigenschaften von Salz nun in mehreren Experimente genauer untersuchen. Die Experimentieranleitungen gibt es schon im Vorraus.
Die Reihenfolge, in der die Experimente durchgeführt werden, ist beliebig! |
| VERSUCH:
Station Türkis (am Lehrertisch) Frage: Wie sehen Kristalle aus. Aufbau/Durchführung:
Materialien: Mikroskop-USB-Kamera, Tablet, Zucker, Salz, großes Salzkristall und Kandis-Zucker Aufgabe:
|
| VERSUCH:
Station Grau (am Lehrertisch) Frage: Was passiert beim Zerbrechen von Kristallen Aufbau/Durchführung: Versuche vorsichtig, die Kristalle zu zerspalten. Materialien: Kristall, Hammer, Unterlage Aufgabe:
|
| VERSUCH:
Station Rot Frage: Wie verhält sich Eis beim Schmelzen, wenn Kochsalz zugegeben wird? Aufbau/Durchführung:
Material: Eiswürfel, Kochsalz, Spatel, 2 Bechergläser, Thermometer Aufgabe:
|
VERSUCH:
Aufbau/Durchführung:
Entsorgung:
Materialien: Kochsalz, Spatel, 2 Reagenzgläser, Holzklammer, Gasbrenner (→ Schrank), Feuerzeug, Reagenzglasständer Aufgabe:
|
VERSUCH:
Aufbau/Durchführung:
Materialien: Gasbrenner (→ Schrank), Feuerzeug, Kochsalz, ein anderes Salz, Magnesiastäbchen (in kleinem Reagenzglas, damit es nicht so leicht zerbricht!), Becherglas mit verdünnter Salzsäure (Xi) Aufgabe:
|
Woher kommen die Eigenschaften des Salzes
Wir wollen versuchen die beobachteten Eigenschaften von Kochsalz - als Stellvertreter für die Gruppe der salzartigen Verbindungen - zu erklären. Anfangen werden wir dabei mit der Leitfähigkeit.