Von der Saline zum Kochsalz: Unterschied zwischen den Versionen
(→Wieso sind die Ionen für die Leitfähigkeit der Salzlösungen notwendig?) |
(→Weitere Eigenschaften der Salze betrachten und erklären) |
||
| Zeile 261: | Zeile 261: | ||
==== Salze sind meist wasserlöslich ==== | ==== Salze sind meist wasserlöslich ==== | ||
| + | Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | ||
| − | ==== Salze haben meist hohe Schmelz und Siedetemperaturen ==== | + | {{Kurzregel|Die meisten Salze, also Verbindungen die aus Ionen bestehen, sind wasserlöslich}} |
| + | |||
| + | {{AufgabeNr|7.1|Wie schon beim Thema "Leitfähigkeit" musst wieder}} | ||
| + | |||
| + | {{AufgabeNr|X.X| ... }} | ||
| + | |||
| + | ==== Salze haben meist hohe Schmelz- und Siedetemperaturen ==== | ||
| + | Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | ||
| + | |||
| + | {{Kurzregel|Die meisten Salze haben hohe Schmelz- und Siedetemperaturen, d.h. man muss sie stark erhitzen, bis die schmelzen. Dabei wird das Salz aber nicht zerstört (wie beim Zucker).}} | ||
| + | |||
| + | {{AufgabeNr|8.1|}} | ||
==== Salze haben meist gerade Kanten und glatte Flächen ==== | ==== Salze haben meist gerade Kanten und glatte Flächen ==== | ||
| + | Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | ||
| + | |||
| + | {{Kurzregel|Salze bilden Kristalle mit glatten Flächen und geraden Kanten. Die Form ist typisch für eine Verbindung und kann deshalb auch für deren Identifikation verwende werden.}} | ||
| + | |||
| + | {{AufgabeNr|9.1|}} | ||
==== Salzkristalle sind zwar hart aber meist spröde und zerbrechlich ==== | ==== Salzkristalle sind zwar hart aber meist spröde und zerbrechlich ==== | ||
| + | Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | ||
| + | |||
| + | {{Kurzregel|Die meisten Salze bilden feste Kristalle, aber wenn man sie mit dem Hammer bearbeitet zerspringen sie in kleinere Kristalle der gleichen Form.}} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|10.1|}} | ||
Version vom 11. September 2016, 18:18 Uhr
Inhaltsverzeichnis |
Salz - ein alltäglicher Stoff
- FOLIEN-Quiz - Gesucht ist der Stoff X
| Das, was man umgangssprachlich als Salz bezeichnet, nennt der Chemiker Natriumchlorid.
Salz ist eine Bezeichnung für eine Gruppe von chemischen Stoffen, die alle sehr ähnliche Eigenschaften haben. Das Natriumchlorid, auch Kochsalz genannt, ist dabei in typischer Vertreter. |
- VIDEO - Nicht nur Geschmackssache (nur bis min. anschauen, da dann der Film sich dann mehr auf den industriellen Einsatz beschäftigt, der uns im Moment nicht so sehr beschäftigt!).
|
Auf diesem Arbeitsblatt findet du einige Informationen, über Salz (Kochsalz) und wie es sich im Körper auswirkt. Lies dir die Informationen durch und markiere wichtige Informationen. |
- Beispiele für die Anwendung von Kochsalz/Natriumchlorid
Gewinnung von Salz
Salz kommt als Mineral an verschiedenen Stellen der Erde vor. Das Vorkommen bestimmt, wie man es abaut und für die Verwendungs als Speise- oder Industriesalz gewinnt.
Als Steinsalz, bezeichnet man ein Sedimentgestein, welches in der geologischen Vergangenheit Erde auf natürlichem Weg durch Ausfällung aus konzentriertem Meerwasser entstanden ist und nun in Bergwerken abgebaut wird.
Große Mengen an Salz sind auch im Meerwasser vorhanden. Es ist chemisch gesehen eine Lösung, von Natriumchlorid in Wasser (und in kleineren Mengen einigen anderen Salzen) die einen durchschnittlichen Salzgehalt von 3,5% Massenanteil hat. Der Gesamtsalzgehalt schwankt je nach Meer. Die Ostsee hat einen Salzgehalt von 0,2 bis 2%. Einige Binnenseen ohne Abfluss haben weit höhere Salzanteile im Wasser; das Tote Meer ist für seinen Salzgehalt von 28% bekannt.
|
Gewinnung Salz aus dem Meerwasser Schaut euch Eventuell ist es sinnvoll, den Film zweimal anzuschauen. Beim ersten Mal um einen Überblick zu bekommen und das zweite Mal, um das Schema auszufüllen. |
ACHTUNG: Notiere dir die Menge an eingesetztem Steinsalz und bestimme die Menge an Kochsalz, die du daraus gewinnst. Diese Werte werden für die Aufgabe 3b benötigt! |
Verwende für die folgenden Aufgaben den von dir berechneten Wert:
|
Eigenschaften von Salz untersuchen
Du sollst die Eigenschaften von Salz nun in mehreren Experimente genauer untersuchen. Die Experimentieranleitungen gibt es schon im Vorraus.
Die Reihenfolge, in der die Experimente durchgeführt werden, ist beliebig! |
| VERSUCH:
Station Türkis (am Lehrertisch) Frage: Wie sehen Kristalle aus. Aufbau/Durchführung:
Materialien: Mikroskop-USB-Kamera, Tablet, Zucker, Salz, großes Salzkristall und Kandis-Zucker Aufgabe:
|
| VERSUCH:
Station Grau (am Lehrertisch) Frage: Was passiert beim Zerbrechen von Kristallen Aufbau/Durchführung: Versuche vorsichtig, die Kristalle zu zerspalten. Materialien: Kristall, Hammer, Unterlage Aufgabe:
|
| VERSUCH:
Station Rot Frage: Wie verhält sich Eis beim Schmelzen, wenn Kochsalz zugegeben wird? Aufbau/Durchführung:
Material: Eiswürfel, Kochsalz, Spatel, 2 Bechergläser, Thermometer Aufgabe:
|
VERSUCH:
Aufbau/Durchführung:
Entsorgung:
Materialien: Kochsalz, Spatel, 2 Reagenzgläser, Holzklammer, Gasbrenner (→ Schrank), Feuerzeug, Reagenzglasständer Aufgabe:
|
VERSUCH:
Aufbau/Durchführung:
Materialien: Gasbrenner (→ Schrank), Feuerzeug, Kochsalz, ein anderes Salz, Magnesiastäbchen (in kleinem Reagenzglas, damit es nicht so leicht zerbricht!), Becherglas mit verdünnter Salzsäure (Xi) Aufgabe:
|
Woher kommen die Eigenschaften des Salzes
Wir wollen versuchen die beobachteten Eigenschaften von Kochsalz - als Stellvertreter für die Gruppe der salzartigen Verbindungen - zu erklären. Anfangen werden wir dabei mit der Leitfähigkeit.
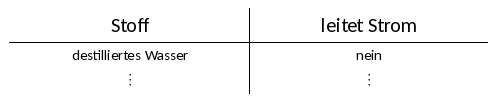
Strom wird geleitet oder eben nicht
Um zu verstehen, warum eine Salzlösung Strom leitet, aber alle anderen betrachteten Stoffe (Salz- und Zuckerkristall, Zuckerlösung, Wasser) aber nicht, müssen wir uns zeurst einmal kurz anschauen, was überhaupt Strom ist:
In der folgenden kleinen Animation kann man sehen, warum eine Batterie eine Lampe zu Leuchten bringt.
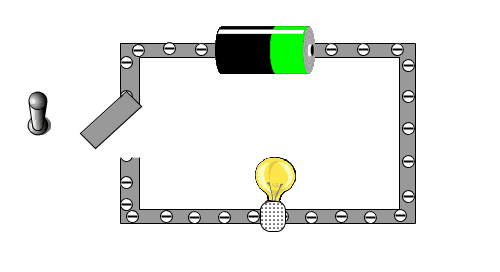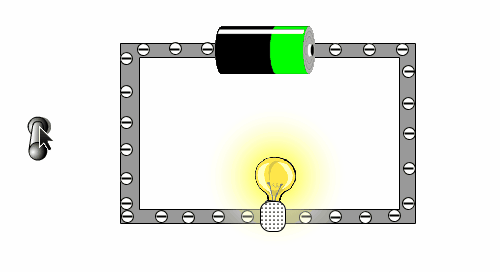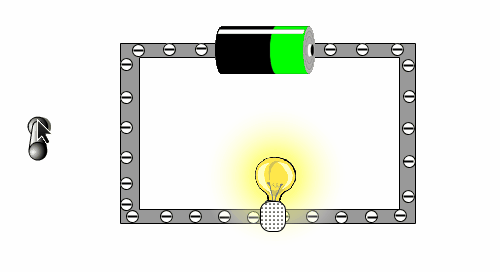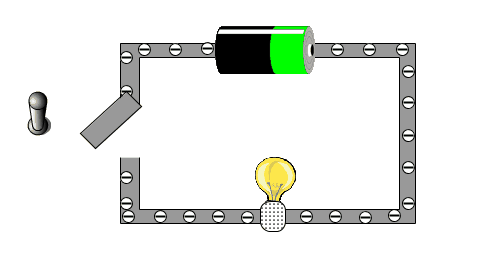
Warum können einige Stoffe den Strom leiten, andere Stoffe aber nicht?
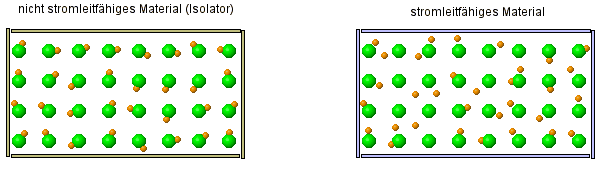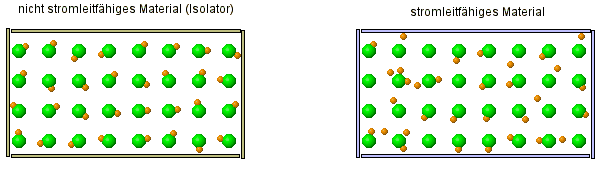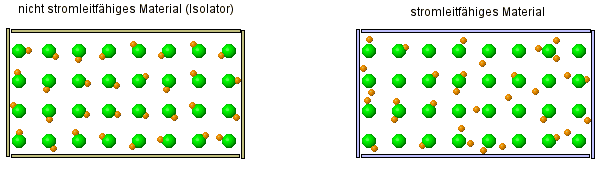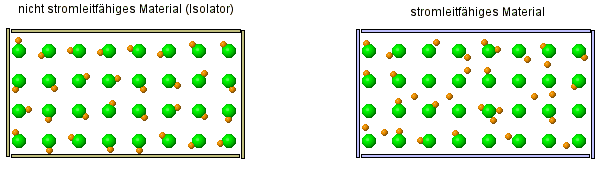
| FAZIT: Atome sind keine kompakten Kugeln, die unzerstörbar sind. Die alte Atomvorstellung reicht nicht mehr aus, dies zu erklären! Wir müssen das Atommodell erweitern. |
Das Rosinenkuchenmodell
Der britische Physiker Joseph Thomson war ein britischer Physiker und Nobelpreisträger für Physik. Er entdeckte 1897 (etwa zeitgleich mit dem deutschen Physiker Emil Wiechert) das Elektron.
Thomson war Professor für Physik am Trinity College der University of Cambridge. Er soll tollpatschig gewesen sein und daher versuchten seine Assistenten und Schüler stets, ihn von den Experimenten fernzuhalten. Also überwachte Thomson nur die Experimente und gab Anweisungen.
Ab 1881 untersuchte er das Verhalten von bewegten Ladungen und setze dabei eine sogenannte Kathodenstrahl-Röhre ein. Seine Untersuchung der Kathodenstrahlung 1897 zum experimentellen Nachweis für die bereits 1874 vorhergesagte Existenz des Elektrons. Thomson konnte auch nachweisen, dass sich bewegende Elektronen durch ein Magnetfeld ablenken ließen, was von deutschen Physiker Heinrich Hertz zuvor bestritten worden war.
Kathodenstrahlröhren kann man technisch als Vorgänger der alten Fernsehen ansehen, also nicht die flachen Displays sondern die dicken und schweren Fernseher.
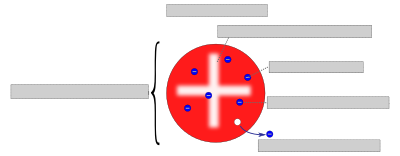
Dies war die erste Entdeckung und der Nachweis eines Teilchens, das kleiner als die Atome war. Darauf basierend entwickelte Thomson das Thomsonsche Atommodell (auch „Rosinenkuchen-“ oder „Plumpudding-Modell“), wonach die sehr kleinen Elektronen Teile der Atome sind und im Inneren der Atome eingebettet seien, wie Rosinen in einem Kuchenteig.
|
Das Bild soll darstellen, wie sich Thomson sein Rosinenkuchenmodell vorstellte. Bearbeite das Bildzuordnungsquiz und versuche die Begriffe richtig zuzuordnen um damit Thomsons Idee zu verstehen. Trage nach der Kontrolle die richtigen Beschriftungen auf das ausgeteilte Arbeitsblatt ein und klebe es dann ins Heft.
|
|
Hast du verstanden, wie Thomson auf sein Atommodell kam? Und was es mit der Stromleitfähigkeit auf sich hat? Zur Kontrolle solltest du auf jeden Fall mal noch dieses Multiple-Choice-Quiz durchgehen. |
Ernest Rutherford und das Streuexperiment
Ernest Rutherford (1871-1937 in Cambridge) war ein aus Neuseeland stammender Physiker, der zunächst als Assistent von Joseph J. Thomson in Cambridge arbeitete. Zunächst beschäftigte er sich mit der Verbesserung der Empfindlichkeit seines Detektors, mit dem er Radiowellen in einer Entfernung von etwa einer halben Meile nachweisen konnte. Thomson, der Rutherfords experimentelles Talent schnell erkannte, lud Rutherford 1896 ein, ihn bei seinen Untersuchungen der elektrischen Leitfähigkeit von Gasen zu unterstützen. Sie benutzten die wenige Monate zuvor entdeckten Röntgenstrahlen, um die Leitfähigkeit in den Gasen auszulösen.1898 wurde Rutherford als Professor an die Universität in Montreal (Kanada) berufen, wo er bis 1907 arbeitete.
Bekannt und berühmt wurde er für das Streu-Experiment, mit der genauer in den Aufbau der Atome eindringen konnte, ohne wirklich hineinschauen zu können.
Übungen zum Kern-Hülle-Modell
- Build an atom / Baue ein Atom
- Isotopes and Atommassen/Isotope und Atommassen
- Reaktionsgleichungen ausgleichen ... mit Schinken und Käse
- Schmelz- und Siedetemperaturen bei Ionen und ungeladenen Teilchen
Wieso sind die Ionen für die Leitfähigkeit der Salzlösungen notwendig?
Das wir uns die Ionen angeschaut haben, hatte seinen Grund. Ursprünglich hatte wir uns mit der Leitfähigkeit der Salzlösung beschäftigt bzw. was Strom und Leitfähigkeit überhaupt ist.
Wenn wir nun die Stromleitfähigkeit mit Hilfe der Ionen erklären wollen, so müssen wir folgende Dinge betrachten und daraus eine schlüssige Kette von Begründungen zusammensetzen:
- Beschreibung der Eigenschaft der Leitfähigkeit und der Hintergründe, die schon bekannt sind.
- Wie verhalten sich Ionen aufgrund ihrer Ladung und wieso spielt das hier eine Rolle?
- Wie kann man die Eigenschaft der Leitfähigkeit aufgrund der Ionen erklären?
Interessant sind die folgenden Animationen, die im Teilchenmodell zeigen, was passiert, wenn eine Salz-Lösung den Strom leitet:
Weitere Eigenschaften der Salze betrachten und erklären
Nachdem wir mit Hilfe der Ionen erklären konnten, warum Salzlösungen stromleitfähig sind, schauen wir uns noch einmal die restliche Eigenschaften an. Mit Hilfe des Buches und weiteren Medien, wie Simulationen, sollt ihr in euer Gruppe Gründe für die Eigenschaften von Salzen = Ionenverbindungen finden.
Salze sind meist wasserlöslich
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können:
| Die meisten Salze, also Verbindungen die aus Ionen bestehen, sind wasserlöslich |
|
Wie schon beim Thema "Leitfähigkeit" musst wieder |
... |
Salze haben meist hohe Schmelz- und Siedetemperaturen
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können:
| Die meisten Salze haben hohe Schmelz- und Siedetemperaturen, d.h. man muss sie stark erhitzen, bis die schmelzen. Dabei wird das Salz aber nicht zerstört (wie beim Zucker). |
Salze haben meist gerade Kanten und glatte Flächen
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können:
| Salze bilden Kristalle mit glatten Flächen und geraden Kanten. Die Form ist typisch für eine Verbindung und kann deshalb auch für deren Identifikation verwende werden. |
Salzkristalle sind zwar hart aber meist spröde und zerbrechlich
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können:
| Die meisten Salze bilden feste Kristalle, aber wenn man sie mit dem Hammer bearbeitet zerspringen sie in kleinere Kristalle der gleichen Form. |