Sauber und schön: Unterschied zwischen den Versionen
(→Was macht den Unterschied zwischen einem Wasser und einem Methan-Molekül?) |
(→Was macht den Unterschied zwischen einem Wasser und einem Methan-Molekül?) |
||
| Zeile 372: | Zeile 372: | ||
| + | {{AufgabeNr|10|2=Suche für die Atome, die beim Wasser und beim Methan vorkommen die Elektronegativitätswerte heraus und notiere sie dir so: | ||
| + | :EN(H) = ... | ||
| + | :... usw. | ||
| + | }} | ||
| + | {{AufgabeNr|10|2=Markiere hier bei dem Wasser- und bei dem Methanmolekül, zu welchen Kern die Bindungselektronen (also die Striche zwischen den Atomen) gezogen werden. Male dazu auf die Bindungsstriche Pfeile. | ||
| + | |||
| + | <center> [[File:H2O.svg|200px]] [[File:Methane-2D-square.png|200px]]</center>}} | ||
[[Kategorie:Polarität]] | [[Kategorie:Polarität]] | ||
Version vom 27. September 2017, 20:48 Uhr
- Waschmaschine Historisch.jpg
Alte Waschmachine, die nach dem gleichen Prinzip funktioniert wie heute
- Bundesarchiv Bild 102-09247, Berlinerin im Schaumbad.jpg
Welche Bedeutung das Reinigungsmittel, wie Seife?
- Gewerbewaschmaschine.jpg
Chemische Reinigung?
- Rednails.jpg
Sauber oder nicht? Schön ... ?
- Жидкость для снятия лака.JPG
Manchmal muss auch der Nagellack weg!
|
Eine Reinigung geschieht dadurch das
|
Tipps für die richtige Reinigung: Cleanipedia mit Reinigungstipps passend zu jedem Fleck!
Inhaltsverzeichnis |
Löslich oder nicht löslich?
Zwei Stoffe sind ineinander löslich, wenn beim Vermischen ein homogenes Gemisch entsteht.
|
Beispiele:
- Milch ist kein homogenes Gemisch, denn mit einem Mikorskop kann man kleine Fetttröpfchen erkennen, die im Wasser verteilt sind (Milch besteht aus Wasser und zum Beispiel 1,5 % Fett)
- Milk glass.jpg
Von außen sieht man keine zwei Bestandteile
- Milkccar.jpg
... genauer betrachtet sieht man die Fetttröpfchen
- Lösungen von Salz oder Kohlendioxid in Wasser sind homogene Gemische, denen man kann nicht erkennenm dass das Waser nicht "rein" ist.
- 90, Israel - panoramio.jpg
Nur am Rand sieht man, dass im Wasser des toten Meeres viel Salz gelöst ist.
- Drinking glass 00118.gif
Die Kohlensäurebläschen verlassen aus der Lösung heraus!
- Wasser und Öl gemischt vermischen sich nicht und man sieht zwei Phasen
30px Aufgabe 1
Übe den Begriff und homogen und das Gegenteil heterogen, indem du in einem Quiz jeweils bei einem Teilchenmodellbild entscheidest, ob man zwei Phasen erkennen kann oder nicht. |
Experimente zum Mischen von Öl und Wasser
Hinweis: Öl ist eine recht zähflüssige Flüssigkeit, was die Nutzung mit einigen Geräten recht unpraktisch macht. Daher wird bei einigen Experimenten das Öl durch etwas ersetzt, was sich wie Öl verhält, aber dünnflüssiger ist.
30px Aufgabe 2
Macht euch Notizen zu den Experimenten entsprechend der Anweisungen, die jeweils bei den einzelnen Experimenten zu finden sind. Es ist Hausaufgabe, dies ordentlich ins Heft zu notieren. Die Nummern der Experimente sind egal, wichtiger ist die Überschrift! |
VERSUCH: 2. Ablenkung durch den Luftballon?
Materialien: Das Experiment ist schon vorbereitet. Falls die Gruppe vor euch vergessen hat, die Flüssigkeiten zurück in die Büretten zu gießen, dann macht dies und nutzt die kleinen Trichter dazu, die auf den Bürtten bleiben sollen. Natürlich sollte der Hahn unten geschlossen sein (steht quer). Außerdem ein aufgeblasener Lauftballon. Aufbau/Durchführung: Der Luftballon dient hier dazu, eine Ladung durch Reiben an einem Pulli/T-Shirt zu erzeugen. Das funktioniert am besten an Kunstfasern, geht aber auch mit Baumwoll-T-Shirts. Ob ihr eine Ladung habt, könnt ihr an frisch gewaschenen, nicht zu kurzen Haaren ausprobieren. Nachdem der Ballon aufgeladen wurde öffnet ihr bei einer der Büretten unten den Hahn und lasst einen feinen Flüssigkeitesstrahl heraus. Dieser sollte zunächst in das jeweilige Becherglas gelangen! Lasst euch nicht zu viel Zeit, damit nicht die ganze Flüssigkeit herausgelaufen ist! Haltet dann den gerade erst aufgeladenen Ballon neben den Flüssigkeitsstrahl ohne ihn zu berühren.
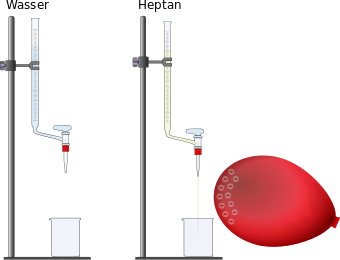 Aufgabe: Haltet in einer kurzen Skizze mit einer Beschreibung das Ergebnis des Experimentes unter der Überschrift "Ablenkung eines Wasserstrahls" im Heft fest. Entsorgung: Die herausgelaufenen Flüssigkeiten werden wieder in die jeweiligen Büretten eingefüllt. Dazu könnt ihr die Büretten auf den Boden stellen, damit man leichter an die Öffnung kommt. Die Bechergläser müssen nicht gereinigt werden. Falls in der Bürette mit dem Wasser zu wenig Wasser enthalten ist, einfach mit Wasser aus dem Wasserhahn nachfüllen, indem ihr euch mit dem Becherglas etwas holt. Nutzt die Trichter, damit nichts daneben geht! |
VERSUCH: 3. Was ist in was löslich?
Materialien: Reagenzglasständer mit 6 Reagenzgläser, 6 Gummistopfen, wasserlöslicher Folienstift, Spritzflasche mit destlilliertem Wasser, 1-Pentanol, Heptan, Ethanol, Papier zum Reinigen der Stopfen Aufbau/Durchführung: Ihr sollt untersuchen, wie gut sich die vier vorhandenen Chemikalien miteinander mischen. Diese 6 Mischversuche führt ihr in jeweils einem Reagenzglas durch. Beschriftet dazu die Reagenzgläser und haltet die verschiedenen Gemische darauf fest, damit ihr nicht den Überblick verliert. Gebt jeweils 1-2 cm der zwei Flüssigkeiten zusammen in das Reagenzglas, verschließt mit einem Stopfen und schüttelt ein wenig, um besser zu mischen. Lasst den Stopfen dann auf dem Reagenzglas und bereitet die nächste Mischung vor. 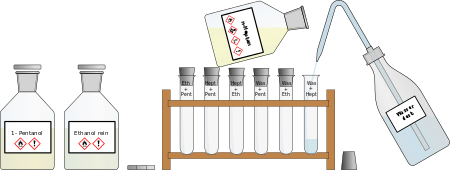 Aufgabe: Nachdem ihr alle Gemische hergestellt habt, haltet das Ergebnis unter der Überschrift "Mischversuche von Wasser mit verschiedenen Lösungsmitteln" fest, indem ihr eine Tabelle folgendermaßen anlegt. Notiert ein "+" , wenn die Stoffe sich miteinander so vermischen, dass man nur noch eine Phase sieht, notiert ein "-", wenn man sieht, dass sie sich nicht mischen lassen und sich zwei Phasen gebildet haben. 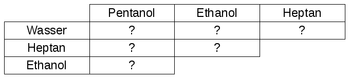 Entsorgung: Die Gemische werden in dem "Abfall-Becherglas" vorne am Lehrertisch gesammelt. Die Reagenzgläser werden nach dem Ausleeren in die Schüssel auf dem Lehrertisch eglegt, damit sie später gereinigt werden. Die Stopfen werden mit Papier abgewischt. |
| VERSUCH: 4. Computer-Experiment: Simulation eines Wasser und Öl Gemisch
Aufbau/Durchführung: Öffne das Programm "SimChemistry" (siehe ....) und von dort aus die Datei "Wasser-Öl-Simulation", das im Verzeichnis "i" zu finden ist. Entsorgung: Schließt das Fenster mit der von euch verwendeten Simulation. Aufgabe: Die blauen Teilchen sind die Wasser-Moleküle, sie haben fest definierte Eigenschaften. Die gelben Teilchen stehen für Teilchen von Öl oder anderen Lösungsmittel. Bei diesen Teilchen kannst du zwei Einstellungen vornehmen.
Verändert die Einstellungen und wartet kurze Zeit, was sich verändert. Sucht verschiedene Einstellungen, bei denen sich die Teilchen mischen bzw. auftrennen. Skizziert dies im Heft und haltet dazu fest, welche Einstellungen vorliegen. |
30px Aufgabe 3
Informiere dich über die Schmelz- und Siedetemperaturen der beteiligen Stoffe an den Experimenten. Halte die Werte in einer Tabelle fest. Dies wird später gebraucht. Vielleicht fällt dir aber schon etwas auf!? |
Lösungsmittel unter der Lupe
Öle sind recht komplizierte Verbindungen und haben große Moleküle. Sie zu beachten und zu verstehen, warum Wasser und Öl so unterschiedlich sind, lenkt von dem eigentlichen Problem ab. Wir beachten daher eine Gruppe von Verbindungen, die sich gut mit Öl vermischen und daher ähnliche Eigenschaften haben. Im Gegensatz zum sind die Moleküle aber recht einfach aufgebaut.
Alkane - gesättigte Kohlenwasserstoff
| Kohlenwasserstoffe sind Verbindungen, deren Moleküle nur aus Kohlenstoff- und Wasserstoffatomen bestehen. Der einfachste Vertreter ist das Methan. |
Als Alkane bezeichnet man Kohlenwasserstoffe, bei denen sich die Atome immer nur jeweils ein Elektronenpaar teilen, dass sie zusammenhalten (Einfachbindung). Dagegen haben die Kohlenstoffatome bei Alkene auch mal vier gemeinsame Elektronen, sie haben Doppelbindungen.
|
30px Aufgabe 4
Informiere dich im Buch über die Alkane. Halte unter der Überschrift "Alkane" im Heft wichtige Informationen fest. Beachte dabei die Aufgabe 4, damit du weißt, was du da machen musst.
|
30px Aufgabe 5
Halte im Heft unter der Überschrift Homologe Reihe Alkane, die ersten 10 Alkane tabellarisch fest. Suche auch nach ihren Siedetemperaturen und halte sie in der letzten Spalte fest Lerne die Namen und die Formeln auswendig.
|
| Namen | Summenformeln | Lewissschreibweise | Siedetemperatur |
|---|---|---|---|
| Methan | 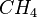 |
80px | -161°C |
| Ethan | ... | ... | ... |
| ... | ... | ... | ... |
}}</center>
30px Aufgabe 6
Übe die Namen und Formeln der ersten Alkane mit Hilfe der zwei Quizze: |
Verzweigt und verzwickt?
Die Struktur (also wie die Atome aneinander hängen) bei den Alkanen scheint verhältnismäßig einfach und klar, aber ab 4 Kohlenstoffatomen taucht ein kleines Problem auf. Das sollst du mit Hilfe des Molekülbaukastens genauer erkunden.
| Ein Molekülbaukasten dient im Chemieunterricht zur Veranschaulichung von Molekülverbindungen. Die verschiedenen Atome werden dabei durch verschiedenfarbige Kunststoffkugeln dargestellt, die mit Hilfe von Verbindungsstücken zusammengestckt werden können. |
30px Aufgabe 7
Baue mit dem Molekülbaukasten die folgenden einfachen Moleküle nach:
|
30px Aufgabe 8a
Schauen dir die Kugeln der folgenden Elemente einmal genauer an:
|
30px Aufgabe 8b
In einer anderen Baukasten-Variante sind auch Schwefelatome enthalten. Vergleiche deine Ergebnisse aus Aufgabe 7a mit dem, was du beim Schwefelatom siehst. Wie ist das erklärbar? |
30px Aufgabe 9
Nimm dir die zweimal die Atome, die du zum Bauen von Butan brauchst (also 4xC und 10xH mit entsprechenden Bindungen).
|
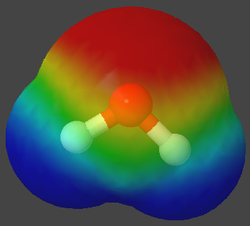
Was macht den Unterschied zwischen einem Wasser und einem Methan-Molekül?
Wie wir schon bei den Siedetemperatur gesehen haben, hat Wasser im Vergleich zu Methan eine sehr viel höhere Temperatur, die sich nicht mit dem Gewicht erklären lässt. Die Experimente haben ja auch gezeigt, dass Wasser-Moleküle sich anziehen müssen. Ionen können allerdings nicht vorliegen, denn sonst wäre Wasser eher eine feste Verbindung. Woher die hohe Siedtemperatur kommt wollen wir nun erklären.
Die folgenden Bilder zeigt spezielle Ansichten von einem Wasser- und einen Methan-Molekül. Dabei wird die Verteilung der Elektronen in den Hüllen der Atome angezeigt. Wobei mit den Farben gezeigt wird, ob ein relativer Elektronenmangel oder -überschuss herrscht.
Um es noch mal zu betonen: hier hat keine echte Ionisierung stattgefunden! Durch eine ungleiche Verteilung der Elektronen
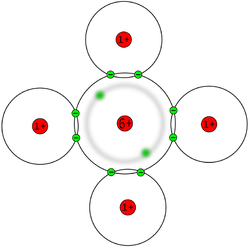
Um die Verteilung der Elektronen erklären zu können, wollen wir an einer Schalenmodelldarstellung vom Methan noch einmal erklären, wie die Atombindung zustande kommt.
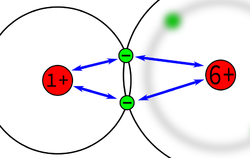
Die Anziehung der Bindungselektronen ist bei den verschiedenen Atome unterschiedlich stark. Die Anziehung hängt ab von
|
Diese Anziehung kann man experimentell bestimmen und dass hat zu eine Liste von Zahlen geführt, den sogenannten Elektronegativitäten.
Die Elektronegativität ist ein Maß für die Fähigkeit eines Atoms, die Bindungs-Elektronen an sich zu ziehen.
|
| IUPAC-Gruppe | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Periode | |||||||||||||||||||
| 1 | Wasserstoff H 2,20 |
Helium He | |||||||||||||||||
| 2 | Lithium Li 0,97 |
Beryllium Be 1,47 |
Bor B 2,01 |
Kohlenstoff C 2,50 |
Stickstoff N 3,07 |
Sauerstoff O 3,50 |
Fluor F 4,17 |
Neon Ne | |||||||||||
| 3 | Natrium Na 1,01 |
Magnesium Mg 1,23 |
Aluminium Al 1,47 |
Silicium Si 1,74 |
Phosphor P 2,06 |
Schwefel S 2,44 |
Chlor Cl 2,83 |
Argon Ar | |||||||||||
| 4 | Kalium K 0,91 |
Calcium Ca 1,04 |
Scandium Sc 1,20 |
Titan Ti 1,32 |
Vanadium V 1,45 |
Chrom Cr 1,56 |
Mangan Mn 1,60 |
Eisen Fe 1,64 |
Cobalt Co 1,70 |
Nickel Ni 1,75 |
Kupfer Cu 1,75 |
Zink Zn 1,66 |
Gallium Ga 1,82 |
Germanium Ge 2,02 |
Arsen As 2,20 |
Selen Se 2,48 |
Brom Br 2,74 |
Krypton Kr | |
| 5 | Rubidium Rb 0,89 |
Strontium Sr 0,99 |
Yttrium Y 1,11 |
Zirconium Zr 1,22 |
Niob Nb 1,23 |
Molybdän Mo 1,30 |
Technetium Tc 1,36 |
Ruthenium Ru 1,42 |
Rhodium Rh 1,45 |
Palladium Pd 1,30 |
Silber Ag 1,42 |
Cadmium Cd 1,46 |
Indium In 1,49 |
Zinn Sn 1,72 |
Antimon Sb 1,82 |
Tellur Te 2,01 |
Iod I 2,21 |
Xenon Xe | |
| 6 | Caesium Cs 0,86 |
Barium Ba 0,97 |
Lanthan La 1,10 |
Hafnium Hf 1,23 |
Tantal Ta 1,33 |
Wolfram W 1,40 |
Rhenium Re 1,46 |
Osmium Os 1,52 |
Iridium Ir 1,55 |
Platin Pt 1,44 |
Gold Au 1,42 |
Quecksilber Hg 1,44 |
Thallium Tl 1,44 |
Blei Pb 1,55 |
Bismut Bi 1,67 |
Polonium Po 1,76 |
Astat At 1,96 |
Radon Rn | |
| 7 | Francium Fr 0,86 |
Radium Ra 0,97 |
Actinium Ac |
Rutherfordium Rf |
Dubnium Db |
Seaborgium Sg |
Bohrium Bh |
Hassium Hs |
Meitnerium Mt |
Darmstadtium Ds |
Roentgenium Rg |
Copernicium Cn |
Nihonium Nh |
Flerovium Fl |
Moscovium Mc |
Livermorium Lv |
Tenness Ts |
Oganesson Og | |
30px Aufgabe 10
Suche für die Atome, die beim Wasser und beim Methan vorkommen die Elektronegativitätswerte heraus und notiere sie dir so:
|
30px Aufgabe 10
Markiere hier bei dem Wasser- und bei dem Methanmolekül, zu welchen Kern die Bindungselektronen (also die Striche zwischen den Atomen) gezogen werden. Male dazu auf die Bindungsstriche Pfeile. |