Heizen und Antreiben: Unterschied zwischen den Versionen
(→Energie bei chemischen Reaktionen) |
(→Energie bei chemischen Reaktionen) |
||
| Zeile 62: | Zeile 62: | ||
| − | {{AufgabeNr|2| | + | {{AufgabeNr|2|2= |
Lies im Buch (Chemie heute I) die Seiten 73 und 75 bis 77 und halte die neuen Begriffe mit Definitionen fest, die mit dem Aspekt des Energieumsatzes bei chemischen Reaktionen zu tun haben. | Lies im Buch (Chemie heute I) die Seiten 73 und 75 bis 77 und halte die neuen Begriffe mit Definitionen fest, die mit dem Aspekt des Energieumsatzes bei chemischen Reaktionen zu tun haben. | ||
{{Kurzregel|Finde Definitionen für innere/chemische Energie, exotherm, endotherm, Aktivierungsenergie, Katalysator, Energiediagramm.}} | {{Kurzregel|Finde Definitionen für innere/chemische Energie, exotherm, endotherm, Aktivierungsenergie, Katalysator, Energiediagramm.}} | ||
| − | < | + | <popup name="Lesetext mit den Informationen"> |
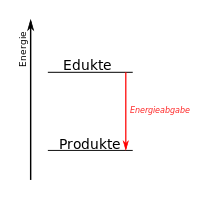
[[Datei:Thermite experiment 01.JPG|thumb|Stark exotherme Reaktion]]Als exotherm (griechisch ἔξω exo ,außen‘ und θερμός thermós ,warm‘, ,heiß‘, ,hitzig‘) bezeichnet man eine chemische Reaktion, wenn deren Produkte einen geringeren Energiegehalt haben als die Ausgangsstoffe. Gelegentlich werden exotherme Reaktionen auch pauschal definiert als Reaktionen, die Wärme abgeben. | [[Datei:Thermite experiment 01.JPG|thumb|Stark exotherme Reaktion]]Als exotherm (griechisch ἔξω exo ,außen‘ und θερμός thermós ,warm‘, ,heiß‘, ,hitzig‘) bezeichnet man eine chemische Reaktion, wenn deren Produkte einen geringeren Energiegehalt haben als die Ausgangsstoffe. Gelegentlich werden exotherme Reaktionen auch pauschal definiert als Reaktionen, die Wärme abgeben. | ||
| − | In einem Energiediagramm kann man das so darstellen. | + | In einem Energiediagramm kann man das so darstellen: |
| + | |||
| + | <center>[[Datei:Exotherm-einfach.svg|200px]]</center> | ||
Typische exotherme Reaktionen sind: | Typische exotherme Reaktionen sind: | ||
| Zeile 77: | Zeile 79: | ||
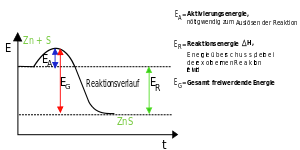
Es erscheint zunächst naheliegend anzunehmen, dass die exothermen Reaktionen gerade diejenigen Reaktionen seien, die freiwillig ablaufen, und dass sie um so heftiger abliefen, je mehr Wärme freigesetzt wird. In vielen Fällen verhalten sich die chemischen Reaktionen auch tatsächlich so. Es gibt aber auch exotherme Reaktionen, bei denen man gar nicht erkennen kann, dass Ernegie abgegeben wird, weil nur wenig Energie frei wird. Ganz freiwillig - also ohne Zutun - laufen aber auch die meisten exotermen Reaktionen nicht ab. Meist bedarf es einer Aktivierungsenergie, die zuerst zugeführt werden muss. | Es erscheint zunächst naheliegend anzunehmen, dass die exothermen Reaktionen gerade diejenigen Reaktionen seien, die freiwillig ablaufen, und dass sie um so heftiger abliefen, je mehr Wärme freigesetzt wird. In vielen Fällen verhalten sich die chemischen Reaktionen auch tatsächlich so. Es gibt aber auch exotherme Reaktionen, bei denen man gar nicht erkennen kann, dass Ernegie abgegeben wird, weil nur wenig Energie frei wird. Ganz freiwillig - also ohne Zutun - laufen aber auch die meisten exotermen Reaktionen nicht ab. Meist bedarf es einer Aktivierungsenergie, die zuerst zugeführt werden muss. | ||
| − | Die Aktivierungsenergie ist eine Art Energie-Barriere, die bei einer chemischen Reaktion von den Reaktionspartnern überwunden werden muss. Allgemein gilt: Je niedriger die Aktivierungsenergie, desto schneller/freiwlliger | + | [[Datei:Energiediagramm exotherm mit Aktivierungsenergie.svg||right|300px]]Die Aktivierungsenergie ist eine Art Energie-Barriere, die bei einer chemischen Reaktion von den Reaktionspartnern überwunden werden muss. Allgemein gilt: Je niedriger die Aktivierungsenergie, desto schneller/freiwlliger läuft die Reaktion ab. Im Verlauf einer chemischen Reaktion findet eine Umgruppierung der Atome, von den Edukten hin zu den Produkten statt, wobei alte Bindungen aufgebrochen und neue Bindungen geknüpft werden. Die Edukte durchlaufen dabei einen aktivierten Zustand, den sog. Übergangszustand (siehe Abbildung rechts, Kurvenmaximum), dessen Erreichen eine bestimmte Energie (Aktivierungsenergie) erfordert. |
| + | Katalysator (''von der Katalyse – griechisch κατάλυσις katálysis, deutsch ‚Auflösung‘ mit lateinischer Endung'') bezeichnet in der Chemie einen Stoff, der die Reaktionsgeschwindigkeit durch die Senkung der Aktivierungsenergie einer chemischen Reaktion erhöht, ohne dabei selbst verbraucht zu werden. Die Menge an freiwerdender Energie bleibt letztendlich aber identisch. | ||
| + | Seit der Antike werden chemische Reaktionen mit Hilfe von Katalysatoren ausgeführt. Erst Jöns Jakob Berzelius kam 1835 zu der Erkenntnis, dass eine Vielzahl von Reaktionen nur erfolgte, wenn ein bestimmter Stoff zugegen war, der jedoch nicht verbraucht wurde. Seiner Meinung nach wurden diese Stoffe nicht umgesetzt, lieferten jedoch durch ihre Anwesenheit die Energie über ihre katalytische Kraft. Er bezeichnete diese Stoffe als Katalysatoren. | ||
| + | Als Regel sollte man sich merken: | ||
| + | {{Kurzregel|Ein Katalysator ist ein Stoff, der die Aktivierungsenergie einer Reaktion herabsetzt (''er hilft sozusagen über den Energieberg''). Er nimmt an der Reaktion teil, geht aber am Ende unverändert aus ihr hervor (''er nimmt dann von neuem an der Reaktion teil''). Die Reaktionsenergie wird nicht verändert. Dadurch wird die Reaktionsgeschwindigkeit erhöht.}} | ||
</popup> | </popup> | ||
Version vom 7. November 2017, 12:15 Uhr
Heizen und Antreiben? ... was hat das mit Chemie zu tun?
Drei wichtige Aspekte, die wir bisher schon bei den anderen Themen angesprochen haben, bringen hier Chemie ins Spiel:
- Welche Stoffe eigenen sich zum Heizen und Antreiben? Was sind ihre typischen Eigenschaften, die bei der Verwendung eine Rolle spielen?
- Welche chemischen Reaktionen laufen bei der Benutzung ab?
- Können wir die Eigenschaften und die Reaktionen auf atomarer Ebene erklären?
Ein wichtiger Aspekt, der hier eine Rolle spielt, den wir bisher noch nicht so intensiv betrachtet haben, ist das Thema "Energie". Dazu eine erste Übung.
Energie bei chemischen Reaktionen
30px Aufgabe 1
Bei den in den folgenden Informationen beschriebenen Vorgängen, finden immer auch chemische Reaktionen statt. Teilweise sogar zwei chemische Reaktionen. Bei allen ist die Umsetzung von Energie von großer Bedeutung.
Die Texte können mit Aufgaben als pdf hier heruntergeladen werden. |
- Die Photosynthese ist ein Prozess, bei dem Lichtenergie durch Lebewesen in chemische Energie umgewandelt wird und organische Stoffe synthetisiert werden. ... Die Synthese dieser Stoffe geht überwiegend von der sehr energiearmen anorganischen Kohlenstoff-Verbindung Kohlenstoffdioxid aus. Aus Kohlenstoffdioxid und Wasser entsteht – durch Energiezufuhr (Licht) – Traubenzucker (Glucose) und Sauerstoff.
Material 2: Chemische Energie
Verwendung chemischer Energie in technischen Systemen
- Aus technischer Sicht ist in Treibstoffen chemische Energie gespeichert, die durch deren Verbrennung, etwa beim Antrieb von Fahrzeugen, in mechanische Energie umgewandelt wird. Brennstoffzellen erlauben den Wandel von chemischen Reaktionsenergie einer Verbrennung direkt in elektrische Energie. Bei Nutzung von Batterien wird über elektrochemische Reaktionen die chemische Energie direkt in elektrische Energie gewandelt. Ein Akkumulator verhält sich bei der Nutzung der Energie ähnlich wie eine Batterie, kann aber auch umgekehrt elektrische Energie in chemische wandeln und so speichern.
Verwendung chemischer Energie in biologischen Systemen
- Aus biologischer Sicht ist in organischer Nahrung chemische Energie gespeichert, die in ATP als Energieträger umgewandelt wird. Grüne Pflanzen beziehen ihre chemische Energie nicht aus organischer Nahrung, sondern aus dem Energiegehalt der Sonnenstrahlung ...
Material 3: Bleiakku
- Bei einem Bleiakkumulator (kurz Bleiakku, besonders beim Kfz auch Starterbatterie) handelt es sich um eine Ausführung des Akkumulators, bei der die Elektroden aus Blei und der Elektrolyt aus verdünnter Schwefelsäure besteht.
- Bei der Entladung reagiert Blei mit Sauerstoff zu Bleioxid und löst sich im Elektrolyt auf. Beim Laden wird die Reaktion umgekehrt und es entsteht wieder metallisches Blei.
Material 4: Wasserstoff als Energieträger der Zukunft
- Wasserstoff scheint eines der Energieträger der Zukunft zu sein. Besonders sauber wird er hergestellt, wenn der für die Aufspaltung von Wasser in Wasserstoff und Sauerstoff benötigte Strom mit Hilfe von Solarzellen gewonnen wird.
- Wird das gasförmige Wasserstoff unter Druck verflüssigt, so kann man ihn auch in Tanks füllen und als Treibstoff verwendet werden. Dabei kann der Wasserstoff direkt mit Sauerstoff verbrannt werden oder die, in ihm enthaltene Energie, wird mit Hilfe einer sogenannten Brennstoffzelle in elektrischen Strom verwandelt werden. Und die „Abgase“? Als einziges Reaktionsprodukt entsteht Wasserdampf.
30px Aufgabe 2
Lies im Buch (Chemie heute I) die Seiten 73 und 75 bis 77 und halte die neuen Begriffe mit Definitionen fest, die mit dem Aspekt des Energieumsatzes bei chemischen Reaktionen zu tun haben.
|
30px Aufgabe 3
Um die neuen Begriffe gleich anwenden zu können gibt es ein Zuordnungsquiz. |