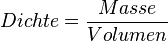Was die Siedetemperatur von Molekülen beeinflusst: Unterschied zwischen den Versionen
(→Dichteanomalie des Wassers) |
(→Dichteanomalie des Wassers) |
||
| Zeile 29: | Zeile 29: | ||
<center>{{#ev:youtube|OfzbHz1e12E}}</center> | <center>{{#ev:youtube|OfzbHz1e12E}}</center> | ||
| + | |||
| + | |||
| + | {| | ||
| + | |- | ||
| + | |Die Tatsache, dass gefrorenes Wasser, also Eis, nicht absinkt ist von wesentlicher Bedeutung für das Überleben auf der Erde. Denn nur so können im Winter die Wasserbewohner überleben. Denn ist das Wasser tief genug, so friert ein Gewässer nicht durch und unten bildet sich eine 4°C kalte Schicht, in der die Wasserbewohner überleben können.||[[File:Anomalous expansion of water Summer Winter.svg]] | ||
| + | |} | ||
| + | |||
| + | |||
| + | |||
| + | Auch dieses Wasserphänomen lässt sich mit Hilfe der Wasserstoffbrücken erklären. Dazu der folgende Film: | ||
| + | |||
| + | <center>{{#ev:youtube|pg0990_wZS4|550}}</center> | ||
| + | |||
| + | '''Erklärung:''' Beim Abkühlen bewegen sich die Wassermoleküle immer langsamer. Die relativ starke Wasserstoffbrücken-Bindung bewirkt die Anordnung der Moleküle in einem sechseckigen Wabengitter. So ist zwischen den Molekülen recht viel Platz. Dieser Platz bewirkt, dass das Volumen viel größer ist als man es erwarten würde. Wird dagegen die Bewegung der Teilchen zu schnell, so zerfällt das Gitter und die Wassermoleküle haben keinen festen Platz mehr. Sie sind enger beieinander und so hat das Wasser bei einer Temperatur knapp über dem Gefrierpunkt ein höhere Dichte (also kleineres Volumen). Beim Abkühlen nehmen die Wassermoleküle wieder von alleine die Position im Wabengitter ein. | ||
Version vom 13. März 2013, 21:35 Uhr
Inhaltsverzeichnis |
Polarität
Wasserstoffbrückenbindung
Van der Waals-Kräfte
Oberflächenspannung
Dichteanomalie des Wassers
Wasser zeigt eine Besonderheit, wenn man die Dichte bei verschiedenen Temperaturen betrachtet. Eine Besonderheit, die es bei keinem anderen Stoff in der Art gibt. Üblicherweise ist es so, dass sich die Dichte eines Stoffes bei sinkender Temperatur erhöht. Grund dafür ist, dass die Teilchen bei sinkenden Temperaturen immer langsamer werden und dadurch näher zusammenrücken können. Da sich dabei das Volumen verringert, wird die Dichte größer, denn die Dichte wird ja berechnet durch
Bei Wasser ist das nicht so. Es hat seine höchste Dichte bei 4°C. Dagegen ist die Dichte bei festem Wasser, also Eis, sehr viel geringer. Hexan verhält sich "normal". Man erkennt, dass die Dichte sich mit der Temperatur kontinuierlich verändert: Je wärmer, desto kleiner wird die Dichte, denn bei einer schnelleren Bewegung brauchen die Teilchen mehr Platz, das Volumen vergrößert sich und so wird der Bruch kleiner.
Im Film zeigt sich dies deutlicher. Man vergleicht das Verhalten von Wasser, mit Wachs und Eisessig (99%iger Essig). Weil die Dichte von Eis geringer ist als die Dichte des umgebenden Wassers kann es im Wasser schwimmen. Beim Wachse und beim Eisessig ist es anders. Die Dichte der Feststoffe ist größer als die der Flüsigkeiten und deshalb gehen sie unter.
| Die Tatsache, dass gefrorenes Wasser, also Eis, nicht absinkt ist von wesentlicher Bedeutung für das Überleben auf der Erde. Denn nur so können im Winter die Wasserbewohner überleben. Denn ist das Wasser tief genug, so friert ein Gewässer nicht durch und unten bildet sich eine 4°C kalte Schicht, in der die Wasserbewohner überleben können. | Datei:Anomalous expansion of water Summer Winter.svg |
Auch dieses Wasserphänomen lässt sich mit Hilfe der Wasserstoffbrücken erklären. Dazu der folgende Film:
Erklärung: Beim Abkühlen bewegen sich die Wassermoleküle immer langsamer. Die relativ starke Wasserstoffbrücken-Bindung bewirkt die Anordnung der Moleküle in einem sechseckigen Wabengitter. So ist zwischen den Molekülen recht viel Platz. Dieser Platz bewirkt, dass das Volumen viel größer ist als man es erwarten würde. Wird dagegen die Bewegung der Teilchen zu schnell, so zerfällt das Gitter und die Wassermoleküle haben keinen festen Platz mehr. Sie sind enger beieinander und so hat das Wasser bei einer Temperatur knapp über dem Gefrierpunkt ein höhere Dichte (also kleineres Volumen). Beim Abkühlen nehmen die Wassermoleküle wieder von alleine die Position im Wabengitter ein.