Aggregatzustände im Teilchenmodell: Unterschied zwischen den Versionen
K (→Viele Teilchen bei unterschiedlichen Temperaturen) |
|||
| Zeile 207: | Zeile 207: | ||
Wen es interessiert, wie die Elektronenmikroskopie bei einem Rasterelektronenmikroskop funktioniert, kann diesen [http://www.youtube.com/watch?v=uXjXx63Nb6k Film] anschauen. | Wen es interessiert, wie die Elektronenmikroskopie bei einem Rasterelektronenmikroskop funktioniert, kann diesen [http://www.youtube.com/watch?v=uXjXx63Nb6k Film] anschauen. | ||
| + | |||
| + | [[Kategorie:Teilchenmodell]][[Kategorie:Aggregatzustände]][[Kategorie:Stoffeigenschaften]][[Kategorie:Simulation]][[Kategorie:Video]] | ||
Version vom 8. Mai 2015, 10:21 Uhr
Inhaltsverzeichnis |
Alkohol und Wasser-Mischung ... eine Zauberei
| VERSUCH:
Durchführung: Man misst in zwei Messzylindern jeweils 50 ml Wasser und 50 ml reinen Alkohol ab. Dann gibt man beide Flüssigkeiten zusammen. Beobachtung: Das Gemisch hat ein Volumen von etwa 98 ml. Deutung: Mit unserem beisherigen Wissen lässt sich diese Phänomen nicht verstehen. Wir müssen uns daher genauer anschauen, was Materie tatsächlich ist. |
Das Ergebnis lässt sich erklären, indem man davon ausgeht, dass beide Stoffe aus kleinsten Teilchen aufgebaut sind. Ist eines der Teilchen sehr viel größer als das andere, so wird bei der Mischung Platz frei, denn die kleinen Teilchen nehmen Platz ein, der vorher unbesetzt war.
Der Vorgang kannst du dir noch einmal ausführlich in einem 15px Film (ohne Ton) anschauen.
Teilchenmodell
Die Teilchen, aus denen unsere Materie aufgebaut ist, sind so klein, dass man sie mit keinem Mikroskop wirklich sehen kann. Bilder wie die folgenden sind Computer-Darstellungen, die aufgrund von Messungen in Elektronen- oder Rasterelektronenmikroskopen möglich sind. Solche Elektronenmikroskope erlauben trotzdem einen gewissen Einblick in die Welt der Teilchen, denn sie können die Anordnung der kleinsten Teilchen deutlich machen, ebenso wie Größenunterschiede, wenn man verschiedene Teilchen in der Probe hat.
aufnahme eines Gold-Kristalls. |
||
| 300px |
Grundregeln zum Teilchenmodell:
|
- WICHTIG: Man muss sich bewusst sein, dass das Teilchenmodell nur ein Hilfsmittel ist, den Aufbau der Materie und das Verhalten der Stoffe zu verstehen. Viele Dinge können damit nicht erklärt werden. Für uns reicht es aber im Moment, dieses einfache Teilchenmodell zu verwenden, mit dem wir dann auch verschiedene Aggregatzustände und die typischen Eigenschaften der Stoffe in einem bestimmten Aggregatzustand erklären können.
Häufig auftretende Fehler:
- Die Eigenschaften eines Stoffes ergeben sich erst aus der Anhäufung von mehreren Teilchen. Die Anziehung der Teilchen untereinander ist natürlich auch bei zwei Teilchen vorhanden.
- So hat ein kleinstes Teilchen keine Farbe. Die Farbe in den Elektronenmikroskop-Aufnahmen sind vom Computer erzeugt! Ein Farbeindruck entsteht dadurch, das ein Teil des weißen Licht durch den Gegenstand, den wir betrachten, verschluckt wird (Absorption). Das sichtbare Restlicht ergibt den Farbeindruck eines Gegenstandes (siehe 19px Remission ). Und einzelne Teilchen können kein Licht zurückwerfen, da sie zu klein sind.
Teilchenmodell anwenden und verstehen lernen
Es ist sicherlich schwer, etwas zu verstehen, was man ja eigentlich nicht sehen kann. Das Teilchenmodell kann aber in Simulationsprogrammen nachgestellt werden. Man kann dabei die Teilchen und deren Eigenschaften sowie die Eigenschaften der Umgebung festlegen. Als Hilfe zum Verstehen des Teilchenmodells nun ein paar Videos, zu denen es Kontrollfragen gibt. Frage nach, falls du Fragen falsch beantwortest und auch nicht verstehen kannst, warum es falsch ist.
| Schau dir den Film einmal an, bevor du die Fragen bearbeitest!
Schau dir die Teilchen an. Welche der drei Teilchen-Arten ziehen sich untereinander am stärksten an? (!Teilchen 1) (Teilchen 2) (!Teilchen 3) Welche Farbe hat der Stoff, in dem die Teilchen 3 enthalten sind? (!Gelb) (!Rot) (Kann man nicht sagen!) Müssen die Teilchen hier im Modell unterschiedlich groß sein? (Nein, denn es ist ja nur ein Modell, mit dem ich einige Eigenschaften verdeutlichen kann.) (!Ja, denn bei verschiedenen Stoffen hat man andere Teilchen) (!Die Größe der Teilchen ist sowieso nicht festgelegt und daher muss man hier auch nicht auf die Größe achten.) |
|
Du kannst dir den Film anschauen, oder aber die Simulationsdatei selber nutzen, wenn du magst. Dazu kannst du auf der Seite SimChemistry nutzen schauen, wie du das Programm starten kannst. Hier kannst du die Datei herunterladen. Wenn wir einen warmen Gegenstand anfassen, spüren wir an unserer Hand ... (die Reibung der Teilchen.) (!die Temperatur der Teilchen.) (!das der Stoff eine hohe Schmelztemperatur hat.) Wie kommt es, dass warmes Wasser seine Wärme an das Metall abgibt, dass ins Wasser eintaucht? (Die schnellen Wasserteilchen stoßen an die Metallteilchen an.) (!Das warme Wasser lässt das Metall schmelzen,, wodurch es warm wird.) Die Schieberegler-Skala geht nur bis 5 K, wobei das K für die Temperatureinheit 19px Kelvin steht. Man sagt, bei 0 K ist der absolute Nullpunkt und es gibt keine tieferen Temperaturen. Wie lässt sich das mit dem Teilchenmodell erklären? (!Es gibt keine Kühlgeräte, die stark genug sind.) (!Das ist eine physikalische Konstante und damit festgelegt.) (Bei 0 K stehen die Teilchen still. Langsamer geht nicht.) |
Teilchenmodell und Temperatur
Was im MC-Test angesprochen nun noch einmal, etwas ausführlicher, als Text zum auffüllen.
Die Bewegung der Teilchen ist eine Art von Energie (kinetische Energie), die der Stoff in sich aufnehmen kann. Die von außen zugeführte Energie lässt die Teilchen deshalb schneller bewegen. Umgekehrt, wenn eine Stoff abgekühlt wird, geben die Teilchen ihre Bewegungsenergie an die Umgebung weiter, indem sie andere Teilchen anstoßen und selber dabei langsamer werden. Der Verlust an Geschwindigkeit bedeutet einen Verlust an Energie und damit Wärme.
Dass die Teilchen sich bei einem heißen Stoff schneller bewegen, können wir mit der Hand spüren. Die schnelle Bewegung der Teilchen erzeugt Reibungswärme, die wir an der Hand fühlen. Bei einer kalten Oberfläche ist es eher umgekehrt. Die Teilchen in unser 37°C warmen Hand können die Teilchen des Stoffes in Bewegung bringen, wordurch dieser eine höhere Temperatur hat.
Wenn die Temperatur eines Stoffes mit der Geschwindigkeit der Teilchen zusammenhängt, dann ist es auch klar, warum man sagt, dass es einen absoluten Nullpunkt gibt. Denn wenn ein Stoff immer mehr abgekühlt wird, wird ja damit auch die Bewegung der Teilchen langsamer. Diese Abkühlung kann nur soweit gehen, bis die Teilchen (zumindest theoretisch) still stehen. Dies soll bei -273°C, oder auch 0 K der Fall sein.
Viele Teilchen bei unterschiedlichen Temperaturen
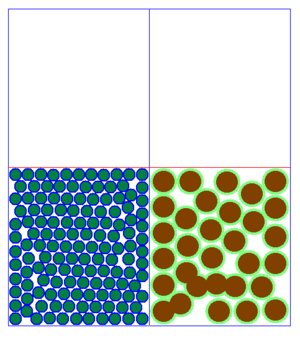
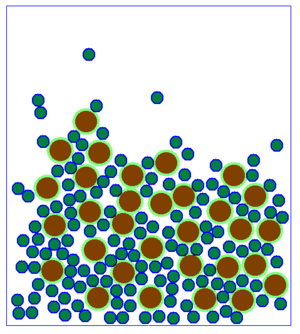
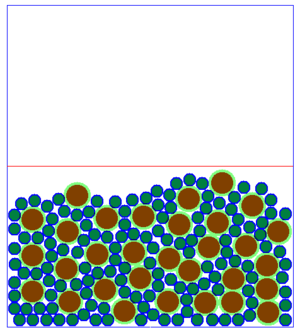
Beobachtet man viele Teilchen auf einmal, so hat die Änderung der Geschwindigkeit auf jedes einzelne Teilchen den gleichen Effekt, wie auf ein einzelnes Teilchen, dass alleine ist. Allerdings sieht das Ganze dann etwas anders aus:
- Hinweis: Das die Teilchen nach unten fallen, bzw. sich eher weiter unten aufhalten hat damit zu tun, dass eine Schwerkraft simuliert wird. Wenn die ausgeschaltet wäre, würden auch langsame oder zusammenhängende Teilchen nicht "unten" liegen sondern herumschweben. Die Position der Teilchen hat also eher einen geringere Bedeutung.
Es fällt auf, dass es beim Aussehen der Teilchenmenge deutliche Unterschiede gibt. Man kann im Grunde genommen drei verschiedene Arten der Anordnung der Teilchen festhalten.
 |
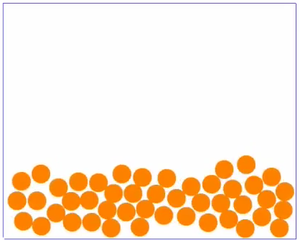 |
 | ||
| Bei sehr niedrigen Temperaturen ist die Bewegung der Teilchen sehr langsam. Die Teilchen sind ganz nah beieinander, haben eine feste Position und bewegen sich nur wenig an ihrer Stelle. Dies ist möglich, weil wegen der langsamen Geschwindigkeit, die Anziehung zwischen den einzelnen Teilchen gut wirken kann. Ein Film, bei dem man Teilchen in Bewegung sieht findest du 15px hier. | Bei mittleren Temperaturen sind die Teilchen zwar auch recht eng beeinander, sind aber nicht - wie bei sehr niedrigen Temperaturen - fest an einer Stelle. Sie bewegen sich in aneinander vorbei, hin und wieder kann ein Teilchen mal die Gruppe verlassen. Da die Geschwindigkeit nicht so hoch wie bei den gasförmigen Soffen ist, kann die Anziehung zwischen den Teilchen etwas wirken, wodurch sie sich meist nicht voneinander entfernen können. Ein Film, bei dem man Teilchen in Bewegung sieht findest du 15px hier. | Bei sehr hohen Temperaturen sind die Teilchen sehr schnell. Sie ziehen sich natürlich immer noch an, aber wegen der schnellen Bewegung kann die Anziehung kaum wirken. So sind die Teilchen weit im Raum verteilt. Ein Film, bei dem man Teilchen in Bewegung sieht findest du 15px hier. |
Da diese drei Teilchen-Anordnungen von der Temperatur abhängen sollte es dir klar sein, dass wir hier sehen, wie die Teilchen bei Stoffen in unterschiedlichen Aggregatzuständen angeordnet sind. Das wollen wir uns noch etwas genauer anschauen und dann auch noch schriftlich festhalten.
Aggregatzustände im Teilchenmodell
Die drei Aggregatzustände haben wir schon behandelt. Wir wollen nun das Teilchenmodell auf sie anwenden und verstehen, wie die Existenz und die schon genannten Eigenschaften der kleinsten Teilchen die typischen Eigenschaften von festen, flüssigen und gasförmigen Stoffen erklärbar machen.
30px Aufgabe 1
Dazu vorab eine Übung, wo es um Stoffeigenschaften geht. Du findest unten einige Eigenschaften genannt, die du dem jeweiligen Aggregatzustand zuordnen sollst. Versuche die Eigenschaft richtig zuzuordnen. Diese Informationen sollen später bei der Aufgabe 3 in einer Tabelle festgehalten werden. Du kannst nach Abschluss dieser Übung schon anfangen, in die erste Spalte die zugeordneten Informationen in Stichworten beim jeweiligen Aggregatzustand festzuhalten. |
| Stoffe in festen Zustand | Das Volumen ist unveränderlich und ein Zusammendrücken ist nicht möglich. | Die Form des Stoffes ist unverändert, und er passt sich nicht an die Form eines Gefäßes an. | Der Stoff ist schwer verformbar | Der Stoff ist schwer teilbar. |
| Stoffe in flüssigen Zustand | Das Volumen ist so gut wie nicht veränderlich, denn in einer geschlossenen Sprite kann man den Stoff quasi nicht zusammendrücken. | Die Form ist veränderlich und der Stoff passt sich an die Form des Gefäßes an. | Der Stoff ist leicht teilbar. | |
| Stoffe in gasförmigen Zustand | Das Volumen ist veränderlich, denn in einer geschlossenen Spritze kann man den Stoff zusammendrücken. | Die Form ist veränderlich, denn der Stoff füllt ein Gefäß, gleich welcher Form, komplett aus. | Der Stoff verteilt sich von alleine im Raum. |
Nun geht es darum, wie man die Eigenschaften mit Hilfe des Teilchenmodell erklären kann.
30px Aufgabe 2
Ordne im Lückentext zu der jeweiligen Stoff-Eigenschaft eine Begründung mit Hilfe des Teilchenmodell zu. Als Anregung solltest du dir noch einmal die drei Bilder mit den orangenen Teilchen anschauen und die Beschreibung dazu durchlesen. |
Erklärung der Eigenschaften von festen Stoffen:
- Das Volumen ist unveränderlich und ein Zusammendrücken ist nicht möglich, weil die Teilchen schon ganz eng beieinander sind und nicht näher zusammenrücken können.
- Die Form des Stoffes ist unveränderbar, und er passt sich nicht an die Form eines Gefäßes an, da sich die Teilchen so stark anziehen können, dass sie immer an ihrer festen Position bleiben.
- Der Stoff ist schwer verformbar, denn aufgrund der großen Anziehung zwischen den Teilchen, bleiben sie an ihren Positionen und sind nicht verrückbar.
- Der Stoff ist schwer teilbar, da sich die Teilchen stark anziehen und man sie nur schwer trennen kann.
Erklärung der Eigenschaften von flüssigen Stoffen:
- Das Volumen ist so gut wie nicht veränderlich, denn in einer geschlossenen Spritze kann man den Stoff quasi nicht zusammendrücken, weil die Teilchen schon so eng beieinander sind, dass man sie so gut wie nicht weiter zusammendrücken kann.
- Die Form ist veränderlich und der Stoff passt sich an die Form des Gefäßes an, denn die Teilchen sind zwar nah beieinander und ziehen sich an, aber sie sind untereinander beweglich und halten nicht ihre Position.
- Der Stoff ist leicht teilbar, da die Anziehung der Teilchen nicht so stark ist, als das dies eine Trennung verhindern kann.
Erklärung der Eigenschaften von gasförmigen Stoffen:
- Das Volumen ist veränderlich, denn in einer geschlossenen Spritze kann man den Stoff zusammendrücken, was möglich ist, da die Teilchen normalerweise recht weit auseinander sind und man den Abstand verringern kann.
- Die Form ist veränderlich und der Stoff füllt ein Gefäß, gleich welcher Form, komplett aus, was man damit erklären kann, dass zwischen Teilchen kaum Anziehungskräfte herrschen und sie sich deshalb überall hin verteilen können.
- Der Stoff verteilt sich von alleine im Raum, wenn er nicht eingeschlossen ist, was man damit erklären kann, dass zwischen Teilchen kaum Anziehungskräfte herrschen und sie sich deshalb überall hin bewegen können.
30px Aufgabe 3
Nutze die leere Tabelle (odt, pdf und halte die Informationen aus den Übungen 1 und 2 fest.
|
Übungen und weitere Beispiele
30px Aufgabe 3
Auf dem Arbeitsblatt (pdf oder odt) sind einige Eigenschaften beschrieben, die nicht nur mit den Aggregatzuständen zu tun haben. Auch andere Eigenschaften von Stoffen lassen sich mit dem Teilchenmodell erklären. Nutze den freien Bereich in der Mitte, um den Satzanfang mit der Begründung zu verbinden.) |
In der Übung sind einige Dinge angesprochen worden, die du dir noch einmal in einem Film oder einer Animation anschauen kannst.
- Diffusion: Darunter versteht man einen natürlich ablaufenden Prozess, der mit der Zeit die vollständigen Durchmischung zweier oder mehrerer Stoffe durch die gleichmäßige Verteilung der beteiligten Teilchen bewirkt.
- Ein 15px englischer Film zeigt sehr ausführlich den Diffusions-Vorgang bei verschiedenen Gasen. Es wird auch gezeigt, wie sich unterschiedliche Temperaturen sich auf die Geschwindigkeit der Diffusion auswirken.
- Brown'sche Bewegung: Dabei handelt es sich um die Beobachtung des schottischen Botanikers Robert Brown im Jahr 1827, der unter dem Mikroskop beobachtete, wie Pollen in einem Wassertropfen unregelmäßig zuckende Bewegungen machten.
- Siedetemperatur: Da sich beim Sieden, also dem Übergang von flüssig zu gasförmig, die Teilchen eines Stoffes voneinander trennen müssen, ist die Stärke der Anziehung der Teilchen untereinander von wesentlicher Bedeutung. Teilchen mit starker Anziehung bedeuten für den Stoff, dass er eine hohe Siedetemperatur haben muss.
- Verdunstung: Wasser hat eine Siedetemperatur von 100°C. Trotzdem verschwindet es auch bei Temperaturen um 20°C in recht kurzer Zeit. Der Grund ist der, dass die Wasserteilchen sich zwar sehr stark anziehen, aber sehr leicht sind.
- In einem Simulationsivdeo siehst du zwei Teilchen, die die gleiche Anziehung haben, aber unterschiedlich schwer sind. DIe leichten Teilchen fliegen, wenn sie man aus Versehen die Menge verlassen, weiter als die schweren Teilchen.
- Löslichkeit: Stoffe, die man auflöst verschwinden scheinbar. Als Feststoff sind ja viele Teilchen eng beieinander. Nur deshalb kann man den Stoff überhaupt sehen. Im Wasser dagegen sind die Teilchen des Feststoffes voneinander getrennt und im Wasser verteilt. Da die einzelnen Teilchen zu klein sind, sieht amn sie nicht mehr.
- In einem Video wird der Lösungsvorgang simuliert.
Ergänzend
Wen es interessiert, wie die Elektronenmikroskopie bei einem Rasterelektronenmikroskop funktioniert, kann diesen Film anschauen.