Von der Saline zum Kochsalz: Unterschied zwischen den Versionen
(→Gewinnung von Salz) |
(→Eigenschaften von Salz untersuchen) |
||
| Zeile 69: | Zeile 69: | ||
== Eigenschaften von Salz untersuchen == | == Eigenschaften von Salz untersuchen == | ||
| − | + | Du sollst die Eigenschaften von Salz nun in mehreren Experimente genauer untersuchen. Die Experimentieranleitungen gibt es schon im Vorraus. | |
| − | * | + | |
| − | * | + | {{AufgabeNr|4| |
| − | + | *Bereite dich auf die Experimente vor, indem du die Anleitungen vorher durchliest. | |
| − | + | * Für alle Experimente sollst du die Durchführung und die Beobachtungen im Heft festhalten. Was genau zu notieren ist, steht bei dem jeweiligen Experiment! | |
| − | + | ||
| − | + | ''Die Reihenfolge, in der die Experimente durchgeführt werden, ist beliebig! | |
| + | ''}} | ||
| + | |||
| + | {{Versuche|1= <big><span style="background:#00FFFF"> Station Türkis (am Lehrertisch) </span></big> '''<u>Frage:</u> Wie sehen Kristalle aus.''' | ||
| + | |||
| + | '''Aufbau/Durchführung:''' Betrachte die kleinen Kristalle mit Hilfe der Mikroskop-Kamera. Vergleiche sie untereinander und mit den großen Kristallen. Was fällt auf. | ||
| + | |||
| + | '''Materialien:''' Mikroskop-USB-Kamera, Tablet, Zucker, Salz, großes Salzkristall und Kandis-Zucker | ||
| + | |||
| + | '''Aufgabe:''' | ||
| + | :Halte im Heft die Überschrift zum Experiment fest: ''"Das Aussehen von Kristallen"''. Skizziere die Form der Kochsalz-Kristalle als Schrägbild. Alternativ kannst du auch zwei Bilder machen, ausdrucken und dann in euer Heft einkleben. Beschreibe mit einem Satz den Vergleich zu den Zuckerkristallen. Gerne dürfen auch hier Fotos ergänzt werden. | ||
| + | }} | ||
| + | |||
| + | |||
| + | {{Versuche|1=<big><span style="background:#BDBDBD"> Station Grau (am Lehrertisch) </span></big> '''<u>Frage:</u> Was passiert beim Zerbrechen von Kristallen''' | ||
| + | |||
| + | '''Aufbau/Durchführung:''' Versuche vorsichtig, die Kristalle zu zerspalten. | ||
| + | |||
| + | '''Materialien:''' Kristall, Hammer, Unterlage | ||
| + | |||
| + | '''Aufgabe:''' | ||
| + | :Halte im Heft die Überschrift zum Experiment fest: ''„Verhalten von Kristallen beim Verformen“''. Beschreibe die Beobachtung im Heft, wenn du willst auch mit einem Foto. | ||
| + | }} | ||
| + | |||
| + | |||
| + | {{Versuche|1=<big><span style="background:#FF0000"> Station Rot </span></big> '''<u>Frage:</u> Wie verhält sich Eis beim Schmelzen, wenn Kochsalz zugegeben wird?''' | ||
| + | |||
| + | Aufbau/Durchführung: Miss dazu die Temperatur des Eises und gib dann Salz hinzu. Beobachte die Temperatur fünf Minuten lang! | ||
| + | |||
| + | '''Material:''' Eiswürfel, Kochsalz, Spatel, 2 Bechergläser, Thermometer | ||
| + | |||
| + | '''Aufgabe:''' | ||
| + | :Halte im Heft die Überschrift zum Experiment fest: „Auswirkung von Kochsalz auf das Schmelzen von Eis“. Notiere deine Beobachtung ins Heft. | ||
| + | }} | ||
| + | |||
| + | {{Versuche|1=<big><span style="background:#0000FF"> Station Blau </span></big> '''<u>Frage:</u> Wie verhält sich Kochsalz und eine Kochsalzlösung gegenüber dem elektrischen Strom? Vergleiche auch mit reiner Wasserlösung, einem Zuckerkristall und Zuckerlösung.''' | ||
| + | |||
| + | '''Aufbau/Durchführung:''' Baue die Schaltung nach der Abbildung auf. Teste, ob bei Berührung der blanken Nägel die Lampe leuchtet. Das sollte der Fall sein, da die Metallnägel ja stromleitfähig sind. | ||
| + | |||
| + | <center>[[Datei:LeitfähigkeitPrüfen.png|400px]]</center> | ||
| + | |||
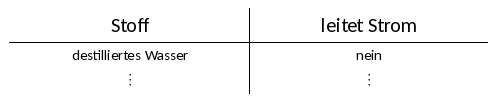
| + | Gib dann zunächst destilliertes Wasser in ein Becherglas und teste, ob die Lampe leuchtet, wenn du die Nägel hineinhältst ''(ohne das die Nägel sich berühren!)''. Da destilliertes Wasser nicht den Strom leitet, sollte die Lampe nicht leuchten ''(ansonsten ist das Becherglas nicht sauber gewesen!!)''. Füge dann unter Umrühren eine kleine Portion Kochsalz hinzu und prüfe wieder die Leitfähigkeit. Gib in das andere Becherglas wiederrum erst destilliertes Wasser, kontrolliere die Leitfähigkeit und dann Zucker. | ||
| + | |||
| + | '''Materialien:''' Kochsalz, Zucker, Salzkristall (auf dem Lehrertisch), Zuckerkristall, destilliertes Wasser, Becherglas, 3 Kabel, Lampe, Batterie, 4 Krokodilklemmen, 2 Nägel, | ||
| + | |||
| + | '''Aufgabe:''' | ||
| + | :Halte im Heft die Überschrift zum Experiment fest: ''„Stromleitfähigkeit von verschiedenen Feststoffen und deren Lösungen“''. Fertige eine Skizze deines Versuchsaufbaus im Heft an und beschrifte sie. Halte außerdem eine kleine Tabelle nach dieser Art fest: | ||
| + | |||
| + | <center>[[Datei:Taballe_für_die_Leitfähigkeitsuntersuchung.png]]</center> | ||
| + | |||
| + | }} | ||
| + | |||
| + | |||
| + | {{Versuche|1=<big><span style="background:#8904B1"> Station Lila </span></big> '''<u>Frage:</u> Wie verhält sich Kochsalz beim Erhitzen im Vergleich zu Zucker.''' | ||
| + | |||
| + | <center>'''Achtung! Nicht das Reagenzglas nach dem Erhitzen berühren; Verbrennungsgefahr!'''</center> | ||
| + | |||
| + | '''Aufbau/Durchführung:''' Erhitze jeweils ein wenig Salz und Zucker (jeweils etwa 0,5 cm) in einem eigenen Reagenzglas. Wenn das Reagenzglas schmilzt, hast du zu lange erhitzt! Es geht darum, wie schnell ein Stoff in der Bunsenflamme schmilzt oder nicht und ob und wie er sich verändert. Wenn man lange erhitzt, wird die Flamme deswegen aber nicht heißer! | ||
| + | |||
| + | '''Entsorgung:''' Wenn sich der Feststoff nach dem Erkalten leicht entfernen lässt, werfe ihn in den Restmüll bzw. in Waschbecken (wegspülen). Klebt der Feststoff im Reagenzglas fest, zeige es beim Lehrer vor. | ||
| + | |||
| + | '''Materialien:''' Kochsalz, Spatel, 2 Reagenzgläser, Holzklammer, Gasbrenner (→ Schrank), Feuerzeug, Reagenzglasständer | ||
| + | |||
| + | '''Aufgabe:''' | ||
| + | :Halte im Heft die Überschrift zum Experiment fest: ''„Erhitzen von Salz“''. Halte dahinter fest, wie schnell/langsam Salz im Vergleich zu Zucker schmilzt und sich dabei verhält. Beschreibe das in ein oder zwei Sätzen. | ||
| + | |||
| + | }} | ||
| + | |||
| + | |||
| + | {{Versuche|1=<big><span style="background:#FE9A2E"> Station Orange </span></big> '''<u>Frage:</u> Wie färbt Kochsalz die Brennerflamme?''' | ||
| + | |||
| + | '''Aufbau/Durchführung:''' Glühe ein Magnesiastäbchen solange in der entleuchteten Brennerflamme bis keine Farberscheinungen mehr zu sehen sind. Tauche die Spitze des Stäbchens in die kleine Flasche mit verdünnter Salzsäure und anschließend in die Kochsalzkristalle, die sich in dem kleinen Becherglas befinden. Halte das Magnesiastäbchen erneut in die Brennerflamme. Bereite das Magnesia-Stäbchen noch einmal vor und halte es in das andere Salz, das in dem kleinen Glas mit Deckel enthalten ist. | ||
| + | |||
| + | '''Materialien:''' Gasbrenner (→ Schrank), Feuerzeug, Kochsalz, ein anderes Salz, Magnesiastäbchen (in kleinem Reagenzglas, damit es nicht so leicht zerbricht!), Becherglas mit verdünnter Salzsäure (Xi) | ||
| + | |||
| + | '''Aufgabe:''' | ||
| + | :Halte im Heft die Überschrift zum Experiment fest: „Färbung der Flamme durch Kochsalz und andere Salze“. Beschreibe, was sich ändert, wenn du das Magnesiastäbchen mit einem der Salze in die Flamme hältst. | ||
| + | }} | ||
== Woher kommen die Eigenschaften des Salzes == | == Woher kommen die Eigenschaften des Salzes == | ||
Version vom 16. Mai 2016, 20:42 Uhr
Inhaltsverzeichnis |
Salz - ein alltäglicher Stoff
- FOLIEN-Quiz - Gesucht ist der Stoff X
| Das, was man umgangssprachlich als Salz bezeichnet, nennt der Chemiker Natriumchlorid.
Salz ist eine Bezeichnung für eine Gruppe von chemischen Stoffen, die alle sehr ähnliche Eigenschaften haben. Das Natriumchlorid, auch Kochsalz genannt, ist dabei in typischer Vertreter. |
- VIDEO - Nicht nur Geschmackssache (nur bis min. anschauen, da dann der Film sich dann mehr auf den industriellen Einsatz beschäftigt, der uns im Moment nicht so sehr beschäftigt!).
|
Auf diesem Arbeitsblatt findet du einige Informationen, über Salz (Kochsalz) und wie es sich im Körper auswirkt. Lies dir die Informationen durch und markiere wichtige Informationen. |
- Beispiele für die Anwendung von Kochsalz/Natriumchlorid
Gewinnung von Salz
Salz kommt als Mineral an verschiedenen Stellen der Erde vor. Das Vorkommen bestimmt, wie man es abaut und für die Verwendungs als Speise- oder Industriesalz gewinnt.
Als Steinsalz, bezeichnet man ein Sedimentgestein, welches in der geologischen Vergangenheit Erde auf natürlichem Weg durch Ausfällung aus konzentriertem Meerwasser entstanden ist und nun in Bergwerken abgebaut wird.
Große Mengen an Salz sind auch im Meerwasser vorhanden. Es ist chemisch gesehen eine Lösung, von Natriumchlorid in Wasser (und in kleineren Mengen einigen anderen Salzen) die einen durchschnittlichen Salzgehalt von 3,5% Massenanteil hat. Der Gesamtsalzgehalt schwankt je nach Meer. Die Ostsee hat einen Salzgehalt von 0,2 bis 2%. Einige Binnenseen ohne Abfluss haben weit höhere Salzanteile im Wasser; das Tote Meer ist für seinen Salzgehalt von 28% bekannt.
|
Gewinnung Salz aus dem Meerwasser Schaut euch Eventuell ist es sinnvoll, den Film zweimal anzuschauen. Beim ersten Mal um einen Überblick zu bekommen und das zweite Mal, um das Schema auszufüllen. |
ACHTUNG: Notiere dir die Menge an eingesetztem Steinsalz und bestimme die Menge an Kochsalz, die du daraus gewinnst. Diese Werte werden für die Aufgabe 3b benötigt! |
Verwende für die folgenden Aufgaben den von dir berechneten Wert:
|
Eigenschaften von Salz untersuchen
Du sollst die Eigenschaften von Salz nun in mehreren Experimente genauer untersuchen. Die Experimentieranleitungen gibt es schon im Vorraus.
Die Reihenfolge, in der die Experimente durchgeführt werden, ist beliebig! |
| VERSUCH:
Station Türkis (am Lehrertisch) Frage: Wie sehen Kristalle aus. Aufbau/Durchführung: Betrachte die kleinen Kristalle mit Hilfe der Mikroskop-Kamera. Vergleiche sie untereinander und mit den großen Kristallen. Was fällt auf. Materialien: Mikroskop-USB-Kamera, Tablet, Zucker, Salz, großes Salzkristall und Kandis-Zucker Aufgabe:
|
| VERSUCH:
Station Grau (am Lehrertisch) Frage: Was passiert beim Zerbrechen von Kristallen Aufbau/Durchführung: Versuche vorsichtig, die Kristalle zu zerspalten. Materialien: Kristall, Hammer, Unterlage Aufgabe:
|
| VERSUCH:
Station Rot Frage: Wie verhält sich Eis beim Schmelzen, wenn Kochsalz zugegeben wird? Aufbau/Durchführung: Miss dazu die Temperatur des Eises und gib dann Salz hinzu. Beobachte die Temperatur fünf Minuten lang! Material: Eiswürfel, Kochsalz, Spatel, 2 Bechergläser, Thermometer Aufgabe:
|
| VERSUCH:
Station Lila Frage: Wie verhält sich Kochsalz beim Erhitzen im Vergleich zu Zucker. Aufbau/Durchführung: Erhitze jeweils ein wenig Salz und Zucker (jeweils etwa 0,5 cm) in einem eigenen Reagenzglas. Wenn das Reagenzglas schmilzt, hast du zu lange erhitzt! Es geht darum, wie schnell ein Stoff in der Bunsenflamme schmilzt oder nicht und ob und wie er sich verändert. Wenn man lange erhitzt, wird die Flamme deswegen aber nicht heißer! Entsorgung: Wenn sich der Feststoff nach dem Erkalten leicht entfernen lässt, werfe ihn in den Restmüll bzw. in Waschbecken (wegspülen). Klebt der Feststoff im Reagenzglas fest, zeige es beim Lehrer vor. Materialien: Kochsalz, Spatel, 2 Reagenzgläser, Holzklammer, Gasbrenner (→ Schrank), Feuerzeug, Reagenzglasständer Aufgabe:
|
| VERSUCH:
Station Orange Frage: Wie färbt Kochsalz die Brennerflamme? Aufbau/Durchführung: Glühe ein Magnesiastäbchen solange in der entleuchteten Brennerflamme bis keine Farberscheinungen mehr zu sehen sind. Tauche die Spitze des Stäbchens in die kleine Flasche mit verdünnter Salzsäure und anschließend in die Kochsalzkristalle, die sich in dem kleinen Becherglas befinden. Halte das Magnesiastäbchen erneut in die Brennerflamme. Bereite das Magnesia-Stäbchen noch einmal vor und halte es in das andere Salz, das in dem kleinen Glas mit Deckel enthalten ist. Materialien: Gasbrenner (→ Schrank), Feuerzeug, Kochsalz, ein anderes Salz, Magnesiastäbchen (in kleinem Reagenzglas, damit es nicht so leicht zerbricht!), Becherglas mit verdünnter Salzsäure (Xi) Aufgabe:
|
Woher kommen die Eigenschaften des Salzes
Wir wollen versuchen die beobachteten Eigenschaften von Kochsalz - als Stellvertreter für die Gruppe der salzartigen Verbindungen - zu erklären. Anfangen werden wir dabei mit der Leitfähigkeit.
Strom wird geleitet oder eben nicht
Um zu verstehen, warum eine Salzlösung Strom leitet, aber alle anderen betrachteten Stoffe (Salz- und Zuckerkristall, Zuckerlösung, Wasser) aber nicht, müssen wir uns zeurst einmal kurz anschauen, was überhaupt Strom ist:
In der folgenden kleinen Animation kann man sehen, warum eine Batterie eine Lampe zu Leuchten bringt.
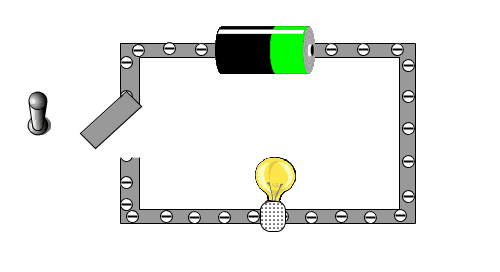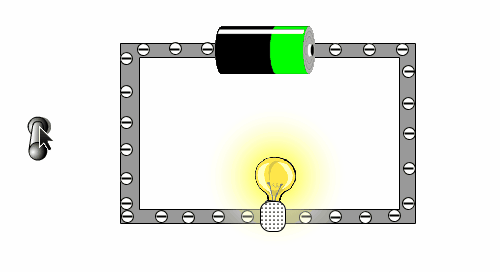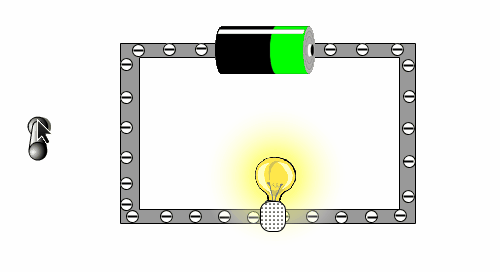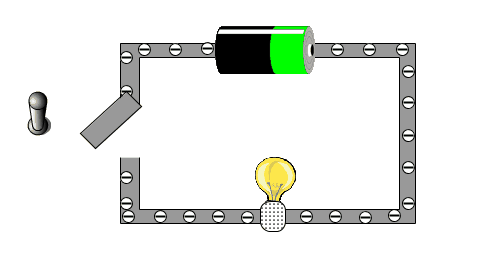
Warum können einige Stoffe den Strom leiten, andere Stoffe aber nicht?
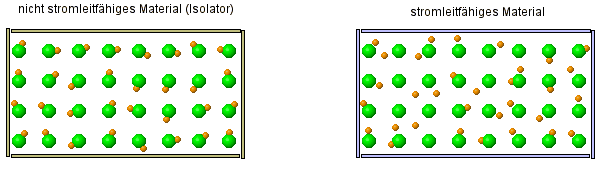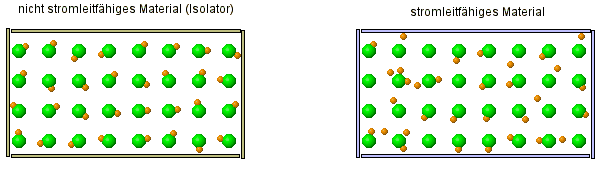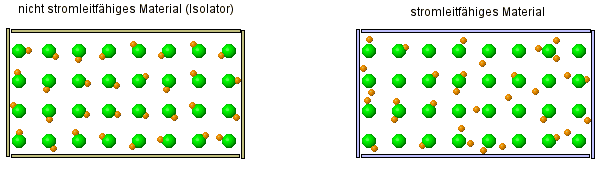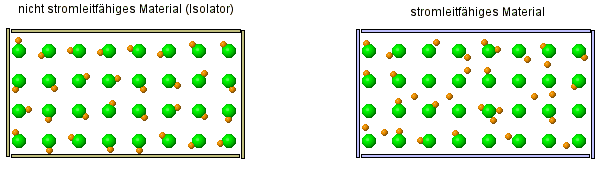
| FAZIT: Atome sind keine kompakten Kugeln, die unzerstörbar sind. Die alte Atomvorstellung reicht nicht mehr aus, dies zu erklären! Wir müssen das Atommodell erweitern. |