Simulationen zu den Aggregatzuständen: Unterschied zwischen den Versionen
(→Etwas Dynamik?) |
|||
| Zeile 82: | Zeile 82: | ||
<center><iframe width="560" height="315" src="https://www.youtube.com/embed/nm5O2X1XPn8?rel=0&showinfo=0" frameborder="0" allowfullscreen></iframe></center> | <center><iframe width="560" height="315" src="https://www.youtube.com/embed/nm5O2X1XPn8?rel=0&showinfo=0" frameborder="0" allowfullscreen></iframe></center> | ||
| + | |||
| + | ==Zusammenhang zwischen Aggregatzuständen und den Teilchen== | ||
| + | Aus der Möglichkeit selber die Temperatur ändern zu können ergibt sich, neben der dynamischen Darstellung, auch die Möglichkeit andere Aufgabenstellungen zu formulieren. So habe ich bereits gute Erfahrung mit der folgenden Unterrichtssituation gemacht: | ||
| + | |||
| + | ::Die Schüler sind am PC in kleinen Gruppen zu zwei oder drei Schülern und haben eine Simulation zur Verfügung, bei der in einem abgeschlossenen Bereich ein größere Menge an Teilchen eingeschlossen ist. Mit einem Schieberegler können sie die Temperatur verändern und sehen daraufhin gleich, wie sich die Geschwindigkeit der Teilchen erhöht und dadurch die Anordnung verändert. Statt auf den Text im Buch einzugehen und die Schüler dies entsprechend der Informationen einfach nur beobachten zu lassen, gebe ich eine einfache Aufgabe: ''„Bei welcher Temperatur schmilzt der Stoff bzw. wird er gasförmig?“'' Hier haben die Schüler etwas zu tun und probieren mit dem Temperaturschieberegler herum. | ||
| + | ::Nach kurzer Zeit frage ich die gefundenen Temperaturen ab. Die Werte sind einigermaßen nah beieinander aber sie unterscheiden sich etwas. Dies nehme ich als Anlass, die Schüler die Entscheidung erklären zu lassen. Genauer, zu erklären, woran sie erkennen, dass der Stoff gerade bei dieser Temperatur schmilzt bzw. verdampft. Erstaunlicherweise nutzen die Schüler genau die Begründungen, die man sonst umständlich erarbeiten muss, von sich aus. So werden automatisch die makroskopischen Eigenschaften der Stoffe als Begründung für die Anordnung und das Verhalten der Teilchen herangezogen. Wie etwa das ein fester Stoff ja an seiner Stelle bleibt und das kann nur der Fall sein, wenn die Teilchen selber auf ihrer Position bleiben. Mit den bisherigen Erarbeitungsmethoden habe ich das nie erlebt. | ||
| + | ::Hier wurden vermutlich die Erfahrungen und das Gelernte aus Klasse 5/6 wieder aufgerufen und dank der dynamischen Darstellung nicht nur noch einmal verdeutlicht sondern hoffentlich auch Fehlvorstellungen korrigiert. | ||
[[Kategorie:Aggregatzustand]] | [[Kategorie:Aggregatzustand]] | ||
[[Kategorie:Teilchenmodell]] | [[Kategorie:Teilchenmodell]] | ||
Version vom 2. Mai 2017, 07:13 Uhr
Inhaltsverzeichnis |
Aggregatzustände im Teilchenmodell
Die Aggregatzustände im Chemie-und Physik-Untericht kann man unter zwei Aspekten betrachten. Zum einen müssen die Namen der Aggregatzustände gelernt werden und dann auch angewendet werden können (von Schmelz- und Siedetemperatur den Aggregatzustand bestimmen). Auf der anderen Seite betrachtet man das Teilchenmodell und wie sich aus der Bewegung der Teilchen die typischen Eigenschaften von festen, flüssigen und gasförmigen Stoffen ergeben.
Stand der Dinge
Bisher sind in Büchern zu diesem Thema meist statische Bilder zu sehen, wie die folgenden. Sie stellen die Anordnung der Teilchen in verschiedenen Aggregatzuständen dar.
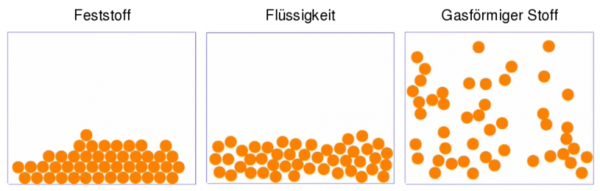
Begleitend dazu gibt es einen Text, der beschreibt, was mit den Teilchen geschieht, wenn man bei einem Feststoff, z.B. Eis, die Temperatur erhöht:
- Die Teilchen, die zunächst regelmäßig angeordnet sind und nur um ihre Position schwingen, bewegen sich erhöhter Temperatur zunehmen schneller und irgendwann verlieren sie ihre Ordnung – der Stoff schmilzt. Mit weiterer Erhöhung der Temperatur verlieren die Teilchen ihrem Zusammenhalt und bewegen sich frei im Raum, dann hat man einen Stoff im gasförmigen Aggregatzustand.
Sich dies alles, trotz der ausführlichen Erklärung dazu, bildlich vorstellen zu können, ist nicht einfach. Es kommt leicht zu Fehlvorstellungen. Ein wichtiger Aspekt ist zum Beispiel, dass die Anziehung der Teilchen untereinander in einem Stoff immer konstant ist. Aufgrund der immer schneller werdenden Bewegung aber kann die Anziehung nicht wirken.
Viele Schüler sehen aber nur das statische Bild mit den unbewegten Teilchen und argumentieren, dass die Teilchen sich im Feststoff stärker anziehen und deshalb näher beieinander sind. So fehlt das grundlegende Verständnis der Eigenschaft, die die Schmelz- und Siedetemperatur der Stoffe bestimmt, nämlich die Stärke der Anziehung bei den Teilchen untereinander. Und dies wird bis zum Abitur benötigt.
Etwas Dynamik?
Etwas moderner wäre eine Variante, wo man statt der statischen Bilder kleine Animationen hat, die zumindest die Teilchenbewegungen zeigen. Mit Hilfe von gif-Animation lässt sich das durchaus leicht machen. Die folgenden Bilder zeigen drei einfach Simulationen in SimChemistry, die mit einem Screencast-Programm abgefilmt wurden. Da die gif-Bilder immer wieder von vorne anfangen hat man eine andauernd bewegte Animation, so dass genug Zeit bleibt, Teilchen zu beobachten.
- Hinweis: Die Gifs starten nicht immer oder brauchen einige Zeit, bis sie loslaufen. Eventuell wäre es sinnvoll, die Bilder einzelnen anzuschauen. Im roten Kasten wird vorgeschlagen, wie man vorgehen kann, um den Schülern die Darstellungen direkt aufs Smartphone zu bringen.
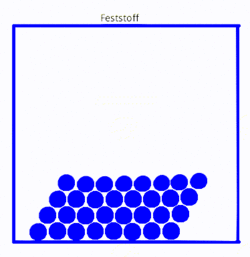
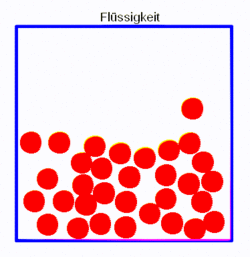
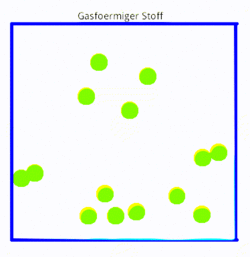
|
IDEE: Arbeitsblätter könnten mit diesen Simulations-Animationen verbunden werden, indem man QR-Codes nutzt, um direkt auf ein Bild zu verweisen. Der QR-Code rechts verweist auf das Bild des Feststoffes.
|
30px Aufgabe
Aufgabenstellungen für die Schüler
|
Statt den ganz einfachen Simulationen, bei denen man nur die sich bewegenden Teilchen zeigt, kann man noch kleine Ergänzungen hineinbringen. So könnte man einige typische Eigenschaften der Stoffe in solchen Simulationen zeigen.
- Die Flüssigkeit nimmt den Platz im Gefäß ein, der ihr geboten wird.
- Gasförmige Stoffe verteilen sich im Raum, wenn sie nicht eingeschlossen sind.
30px Aufgabe
Aufgabenstellungen für die Schüler
|
Temperatur veränderlich
In den vorherigen Simulationen kann man nicht die Temperatur verändern. Die Temperatur in dem Simulation-System wurde so eingestellt, dass mit den entsprechenden Teilchen eben ein Feststoff, eine Flüssigkeit und und gasförmiger Stoff im Teilchenmodell dargestellt werden.
In SimChemistry kann man aber auf der Simulationsoberfläche auch
Feinheiten
Warum gibt es eigentlich Stoffe mit unterschiedlichen Aggregatzuständen?
Das kann man genauer erklären, wenn man zwei Aspekte einzeln betrachtet:
- Je wärmer die Umgebung desto schneller bewegen sich die Teilchen (was ja schon vorher sichtbar war)
- Teilchen können sich mehr oder weniger stark anziehen.
Auch das kann man gut in SimChemistry simulieren:
So kann man ein einzelnes Teilchen betrachten und zeigen, wie sich seine Geschwindigkeit an die veränderte Temperatur anpasst. Dabei muss allerdings erwähnt werden, dass das Teilchen erst langsamer oder schneller wird, wenn es die Wand berührt, die die Temperatur bestimmt, indem es Energie aufnimmt/abgibt. Das ist ein durchaus wichtiger Aspekt, dass Teilchen nicht einfach schneller werden, wenn die Umgebung wärmer ist. Denn auch Luft enthält ja Teilchen und Wärme (= höhere Energie) wird nur übertragen, wenn ein Teilchen mit einem anderen Kontakt hat. Hier ist es eben die Wand, die die Wärme überträgt.
Wie sich die verschieden starke Anziehung von Teilchen auswirkt, kann man in einer Simulation darstellen, bei der jeweils zwei gleiche Teilchen in einem Kästchen gegeben sind. Aufgabe der Schüler ist es, zu erkennen, welche Teilchen sich stärker anziehen. Die Unterschiede wurden bewusst so gewählt, dass sie nicht extrem deutlich sind. Hier ziehen sich die Teilchen in der Mitte am stärksten an, die linken mittelstark, die rechten am wenigsten stark. (Der "Film" in ein animiertes gif!)

Wie sich solche unterschiedlichen Anziehungen dann auf den Stoff und damit die Schmelz- und Siedetemperatur auswirken, kann man dann in einer Simulation zeigen, wo von den drei verschiedenen Teilchen eine größere Menge vorhanden ist. Zu Beginn der Simulation sind die drei Stoffe in den drei verschiedenen Aggregatzuständen. Der eine Stoff hat eine so hohe Siedetemperatur, dass man ihn nur zum Schmelzen bekommt.
Zusammenhang zwischen Aggregatzuständen und den Teilchen
Aus der Möglichkeit selber die Temperatur ändern zu können ergibt sich, neben der dynamischen Darstellung, auch die Möglichkeit andere Aufgabenstellungen zu formulieren. So habe ich bereits gute Erfahrung mit der folgenden Unterrichtssituation gemacht:
- Die Schüler sind am PC in kleinen Gruppen zu zwei oder drei Schülern und haben eine Simulation zur Verfügung, bei der in einem abgeschlossenen Bereich ein größere Menge an Teilchen eingeschlossen ist. Mit einem Schieberegler können sie die Temperatur verändern und sehen daraufhin gleich, wie sich die Geschwindigkeit der Teilchen erhöht und dadurch die Anordnung verändert. Statt auf den Text im Buch einzugehen und die Schüler dies entsprechend der Informationen einfach nur beobachten zu lassen, gebe ich eine einfache Aufgabe: „Bei welcher Temperatur schmilzt der Stoff bzw. wird er gasförmig?“ Hier haben die Schüler etwas zu tun und probieren mit dem Temperaturschieberegler herum.
- Nach kurzer Zeit frage ich die gefundenen Temperaturen ab. Die Werte sind einigermaßen nah beieinander aber sie unterscheiden sich etwas. Dies nehme ich als Anlass, die Schüler die Entscheidung erklären zu lassen. Genauer, zu erklären, woran sie erkennen, dass der Stoff gerade bei dieser Temperatur schmilzt bzw. verdampft. Erstaunlicherweise nutzen die Schüler genau die Begründungen, die man sonst umständlich erarbeiten muss, von sich aus. So werden automatisch die makroskopischen Eigenschaften der Stoffe als Begründung für die Anordnung und das Verhalten der Teilchen herangezogen. Wie etwa das ein fester Stoff ja an seiner Stelle bleibt und das kann nur der Fall sein, wenn die Teilchen selber auf ihrer Position bleiben. Mit den bisherigen Erarbeitungsmethoden habe ich das nie erlebt.
- Hier wurden vermutlich die Erfahrungen und das Gelernte aus Klasse 5/6 wieder aufgerufen und dank der dynamischen Darstellung nicht nur noch einmal verdeutlicht sondern hoffentlich auch Fehlvorstellungen korrigiert.


