Aluminium-Gewinnung mit Hilfe der Schmelzflusselektrolyse: Unterschied zwischen den Versionen
| Zeile 9: | Zeile 9: | ||
* Dann den Zusammenhang zwischen Definitionen und der zu erklärenden Beobachtung/Tatsache herstellen. | * Dann den Zusammenhang zwischen Definitionen und der zu erklärenden Beobachtung/Tatsache herstellen. | ||
}} | }} | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Eigenschaften == | == Eigenschaften == | ||
Aktuelle Version vom 30. August 2018, 20:36 Uhr
Halte den Seitennamen als Überschrift im Heft fest. Zu den einzelnen Aufgaben brauchst du nicht die Nummer aufschreiben. Die Aufgabenstellungen sollen stichwortartig festgehalten werden. Die Antworten sollen aber ausführlich formuliert werden.
Achtet darauf: Bei Fragen, bei der es darum geht, etwas zu begründen, muss man ...
|
Eigenschaften
Aluminium ist das dritthäufigste Element und häufigste Metall in der Erdkruste. Dort tritt es wegen seiner Reaktionsfreudigkeit fast nur in chemisch gebundenem Zustand auf. Wegen seiner geringen Dichte wird Aluminium gern dort verwendet, wo es auf geringe Masse ankommt, die zum Beispiel bei Transportmitteln zum geringeren Treibstoffverbrauch beiträgt, vor allem in der Luft- und Raumfahrt. Auch im Fahrzeugbau gewann es aus diesem Grund an Bedeutung; hier standen früher der hohe Materialpreis, die schlechtere Schweißbarkeit sowie die problematische Bruchfestigkeit und die zu leichte Verformbarkeit bei Unfällen im Wege.Das reine Leichtmetall Aluminium hat aufgrund einer sich sehr schnell an der Luft bildenden dünnen Oxidschicht ein stumpfes, silbergraues Aussehen. Diese passivierende Oxidschicht macht reines Aluminium bei pH-Werten von 4 bis 9 sehr korrosionsbeständig.
|
Die Verbindung aus Aluminium und Sauerstoff hat die Formel Al2O3 und besteht aus Ionen?
|
|
Vorkommen
Aluminium ist mit einem Anteil von 7,57 Gewichtsprozent nach Sauerstoff und Silicium das dritthäufigste Element der Erdkruste und damit das häufigste Metall. Allerdings kommt es aufgrund seines unedlen Charakters praktisch ausschließlich in gebundener Form vor. Die größte Menge befindet sich chemisch gebunden in Form von Alumosilikaten. Diese Silikate sind zum Beispiel Bestandteil von Ton, Gneis und Granit.
Seltener wird Aluminiumoxid in Form des Minerals Korund und seiner Varietäten Rubin (rot) und Saphir (farblos, verschiedenfarbig) gefunden. Die Farben dieser Kristalle beruhen auf Beimengungen anderer Metalloxide.
Das einzige wirtschaftlich wichtige Ausgangsmaterial für die Aluminiumproduktion ist Bauxit, das seinen Namen von dem Vorkommen in Südfrankreich (Les Baux) hat. Bauxit enthält ungefähr 60 % Aluminiumhydroxid Al(OH)3 , etwa 30 % Eisenoxid (Fe2O3) und Siliciumdioxid (SiO2).
|
Das Aluminiumhydroxid Al(OH)3 ist eine Ionenverbindungen. Dabei ist neben dem Aluminiumion noch das sogenannte Hydroxid-Ion enthalten. Es ist zusammengesetzt und hat die Formel OH. Es ist also eine Molekül mit Ladung. Bestimme aufgrund der Formel Aluminiumhydroxid Al(OH)3 die Ladung des Hydroxid-Ions. |
Gewinnung
Da Aluminium aus den Alumosilikaten aufgrund der Bindungsverhältnisse praktisch nicht isoliert werden kann, ist eine wirtschaftliche großtechnische Gewinnung von metallischem Aluminium nur aus Bauxit möglich.Das in diesem Erz enthaltene Aluminiumoxid/-hydroxid-Gemisch wird zunächst mit Natronlauge aufgelöst, um es von Fremdbestandteilen wie Eisen- und Siliciumoxid zu befreien.
Die Herstellung von Aluminium erfolgt ausschließlich durch Schmelzflusselektrolyse von Aluminiumoxid nach dem Kryolith-Tonerde-Verfahren.
|
Wir haben im Unterricht die Elektrolyse bei einer Lösung durchgeführt. Warum kann man die Elektrolyse auch in einer Schmelze durchführen? |
- Aluminiumoxid - Schmelztemperatur 2045 °C
- Kryolith Na3[AlF6] - Schmelztemperatur 1012 °C
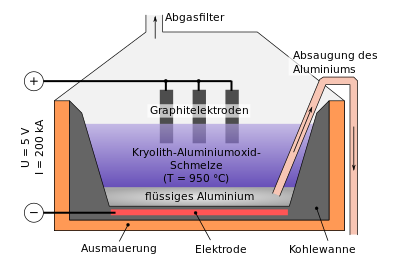
Zur Herabsetzung des Schmelzpunktes wird das Aluminiumoxid zusammen mit Kryolith geschmolzen. Das entstehende Gemisch, welches zu 80 bis 90 % aus Kryolith besteht, hat eine Schmelztemperatur von nur noch ca. 950 °C. Dadurch wird die erforderliche Arbeitstemperatur erheblich verringert, was die Schmelzflusselektrolyse überhaupt erst ermöglicht. Trotzdem ist der Prozess recht energieaufwändig.
|
|
Bestimme mit Hilfe der Edelgasregel die Ladungen der drei Ionen im Kryolith und kontrolliere sie, indem du die Ladungen aller Ionen addierst. |
Bei der Elektrolyse entsteht an der den Boden des Gefäßes bildenden Kathode Aluminium und an der Anode Sauerstoff, der mit dem Graphit (Kohlenstoff) der Anode zu Kohlendioxid und Kohlenstoffmonoxid reagiert.
|
Erkläre, warum sich welches Element an der Kathode bzw. Anode bildet. |
Die Graphitblöcke oben, welche die Anode bilden, brennen wegen des im Prozess entstehenden Sauerstoffs langsam ab und werden von Zeit zu Zeit ersetzt. Die Graphit-Kathode (Gefäßboden) ist gegenüber dem Aluminium inert. Das sich am Boden sammelnde flüssige Aluminium wird mit einem Saugrohr abgesaugt.
|
Wegen dem hohen Energiebedarf ist die Aluminiumherstellung ist nur in der Nähe preiswert zur Verfügung stehender Elektroenergie wirtschaftlich.







