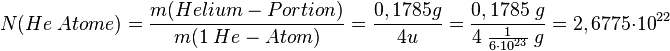Berechnungen von Massen bei Reaktionen
Wiederholung: Stöchiometrische Berechnungen bei der Reaktion von Feststoffen
Satz von Avogadro
Der Italienier Amedeo Avogardo war Professor für mathematische Phsik und untersuchte im 19. Jahrhundert Gase und stieß dabei auf eine Besonderheit bei der Anzahl der Gasteilchen pro Volumeneinheit.
Da wir die Experimente praktisch nicht nachvollziehen können, gehen wir eher theoretisch an und schauen uns bekannte Messwerte zu Gasen an, nämlich deren Dichte.
Da wir ja inzwischen wissen, wie die Masse von einem Atom ist können wir über die Dichte die Anzahl der Atome in einer Gasportion berechnen. Genauer: Es soll bestimmt werden, wieviele Teilchen in in einem Liter eines Gases enthalten ist. Dies soll hier am Beispiel von Helium gezeigt werden. Dabei gehen wie folgendermaßen vor:
- 1. Schritt: Berechne die Masse von 1 Liter des Gases. Dazu nutzen wir die Formel der Dichte
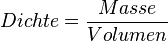 bzw. mit Symbolen
bzw. mit Symbolen 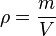 , die wir nach der Masse m umformen
, die wir nach der Masse m umformen 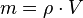 .
.
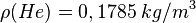 , ,dann ist |
- 2. Schritt: Dann berechnet man, wieviele Teilchen enthalten sind, denn man weiß ja was ein Teilchen wiegt.
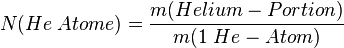
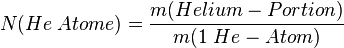 Ein Helium-Atom wiegt ja 4 u. Die Einheit u kann man in g umrechnen mit dem Faktor |
Um die gleiche Rechnung für verschiedene Gase etwas schneller durchführen zu können, habe ich ein GeoGebra-Applet vorbereitet.

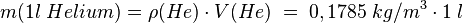 .
. 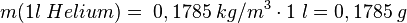
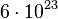 . So hat man dann:
. So hat man dann: