Anwendung der Symbolschreibweise 2 - Reaktionen beschreiben
| 50px | Im Buch zu lesen: Zum Thema Reaktionsgleichungen - Reaktionen in Formelsprache findest du in unserem Buch Informationen auf 147. Da diese Informationen aber sehr knapp sind, gibt es hier eine ausführliche Anleitung mit vielen Übungen.. |
|
Nachweis zur selbstständigen Erarbeitung des Themas Reaktionen mit der Symbolschreibweise beschreiben
|
Inhaltsverzeichnis |
Warum bringt die Symbolschreibweise mehr als Worte?
Bisher haben wir die Edukte und Produkt einer chemischen Reaktion immer mit Worten beschrieben. Lästig ist daran vor allem, dass die Namen manchmal etwas lang sind. Einige von euch waren deshalb versucht, die Symbolschreibweise, die ihr das erste Mal schon vor einiger Zeit kennengelernt hattet, beim Aufschreiben von Reaktionen zu nutzen.
Allerdings ist dies nicht so einfach, denn beim Reaktionsschema wird die Reaktion nur qualtitativ betrachtet:
Es geht also nur darum, welche Stoffe an der Reaktion beteiligt sind.
Eine Reaktionsgleichung dagegen enthält sowohl qualitative als auch quantitative Informationen:
Neben den Stoffen, die in Symbolschreibweise angegeben sind, wird nämlich auch genau angegeben wieviele Wasserstoff- und Sauerstoffteilchen da miteinander reagieren und wieviele Wassermoleküle dabei heraus kommen. Man muss dann natürlich auch dabei beachten, dass die Anzahl der Wasserstoffatome, die man in die Reaktion "hineinsteckt" auch hinten wieder "hinauskommen". Denn Atome können weder zerstört noch plötzlich erschaffen werden.
- Zur Erinnerung ... Daltons Atomtheorie besagt: Bei chemischen Reaktionen werden Atome nur umgelagert.
Das ist nun ein neuer Aspekt, der vorher nicht wichtig war, da wir nur an die beteiligten Stoffe an sich gedacht haben. Auch das Gesetz zur Erhaltung der Masse reicht da nicht aus, wird aber von Daltons Idee bestätigt.
- Wenn ich von jeder Atomsorte vor und nach der Reaktion die gleiche Anzahl habe, bleibt natürlich auch die Masse bei der chemischen Reaktion gleich.
Ein sich daraus ergebender Vorteil ist, das man etwa hier in dem Beispiel schon vorhersagen kann, wieviel Sauerstoff man braucht, damit man ein stöchiometrisches Knallgas-Gemisch hat. Ich habt ja schon mitbekommen, das die Reaktion von reinem Wasserstoff mit der Umgebungsluft sehr viel schwächer ist, als wenn man es im richtigen Verhältnis mit Sauerstoff mischt.
Begleitet wird uns dabei das Eisen ... wie im Bild oben angedeutet ... an dem wir exemplarisch Reaktionen in Symbolschreibweise notieren und später auch quantitative Berechnungen vornehmen werden. Bei den Eisenoxiden haben wir auch die Besonderheit, die wir schon von anderen Metallen kennen. Dass es nämlich verschiedene Oxide gibt, bei denen das Atomanzahlverhältnis von Eisen- zu Sauerstoff-Atomen unterschiedlich ist. Mit der Symbolschreibweise können wir das aber ganze genau angeben.
Atome zählen
Wie schon erwähnt enthalten Reaktionsgleichungen qualitative und quantitative Informationen. Wie man Verbindungen benennt bzw. wie man aufgrund des Namens auf die richtige Formel kommt, hast du im letzten Abschnitt geübt. Nun geht es um das Quantitative ... bei Reaktionsgleichungen aber nicht um das Wiegen sondern um das Zählen der Atome.
Betrachten wir noch einmal die Reaktion vom Wasserstoff mit Sauerstoff:
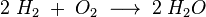
Für das Zählen schauen wir natürlich nach den Zahlen und da gibt es zwei Typen:
Index nennt man die kleine, tiefgestellten Zahlen, die hinter einem Atom stehen und angeben, wie oft dieses Atom in einem Molekül vorkommt.
Stöchiometrischer Faktor oder Koeffizient nennt man die großen Zahlen, die vor den Atome bzw. Teilchen stehen.
|
30px Aufgabe 1
In diesem Test sollst du Atome zählen. Dabei kommen sowohl Indizes als auch stöchiometrische Faktoren vor. Es gibt zwei einzelne Test, wobei du den Ersten mindestens machen musst. Der zweite ist etwas schwieriger, da teilweise kompliziertere Formeln vorkommen. |
30px Aufgabe 2
In dieser Übung sollst du den stöchiometrischen Koeffizienten bestimmen, um auf einen bestimmte Anzahl von Atomen zu kommen. Auch hier gibt es zwei Übungen, die du aber beide bearbeiten sollst. |
Zählen wir mal, ob bei der Reaktionsgleichung zur Verbrennung von Wasserstoff auch die Anzahl der Atome stimmt. Dazu notiere ich für jedes vorkommende Element in einer eigenen Zeile unter der Reaktionsgleichung wieviele Atome der Sorte bei jedem Stoff enthalten sind.
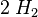 |
+ | 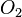 |
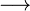 |
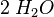
| |
| Anzahl O-Atome | 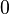 |
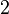 |
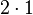
| ||
| Anzahl H-Atome | 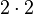 |
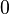 |
|
- Man sieht, dass die Anzahl der Sauerstoff-Atome bei den Edukten und bei den Produkten zwei ist.
- Und es gibt jeweils bei den Edukten und Produkten vier Wasserstoffatome.
Damit haben wir vor der Reaktion gleichviele Atome jeder Sorte, wie nach der Reaktion. Eine Reaktionsgleichung kann nur dann richtig sein, wenn dies stimmt. Natürlich stimmt dann auch das Gesetz von der Erhaltung der Masse.
| Die Anzahl der Atome jedes Elementes muss vor und nach der Reaktion gleich sein. |
Ein weiteres Beispiel mit anderen Stoffen und mehr Atomen. Dabei habe ich die Anzahl der Atome für alle Produkte bzw. alle Edukte immer gleich zusammengeschrieben.
| Ethanol | + | Sauerstoff |  |
Kohlenstoffdioxid | + | Wasser | |
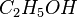 |
+ | 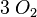 |
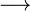 |
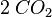 |
+ | 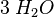
| |
| Anzahl O-Atome | 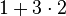 |
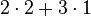
| |||||
| Anzahl H-Atome | 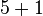 |
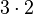
| |||||
| Anzahl C-Atome | 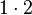 |
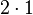
| |||||
- Sauerstoffatome jeweils 7, Wasserstoffatome jeweils 6, Kohlenstoffatome jeweils 2
- Auch hier ist die Reaktionsgleichung richtig!
| Beim Überprüfen von Reaktionsgleichungen sollte man immer die Anzahl der Atome bei den Edukten und Produkte kontrollieren. |
TIPP: Im oben gezeigten Beispiel könnte man noch Farben verwenden, um die Herkunft der Zahlen zu verdeutlichen. Dies solltest du zumindest in einem Beispiel mal selber machen. Die "Einsen", die ich hier in der Rechnung dazugeschrieben habe, könnte man dann auch in der Reaktionsgleichung ergänzen, auch wenn Sie als Indizes oder Stöchiometrische Faktoren nicht aufgeschrieben werden.
30px Aufgabe 3
Hier sollst du kontrollieren, ob die gegebene Reaktionsgleichung richtig ist. Gefragt ist, ob die Anzahl richtig ist oder welche Atomanzahl nicht richtig ist. |
Einfache Reaktionsgleichungen vervollständigen
Bei den letzten Übungen gab es schon einige Reaktionsgleichungen, die recht kompliziert waren oder zumindest aussahen. Du sollst nun lernen, selber Reaktionsgleichungen auszugleichen. Dabei wirst du eine Reaktion vorgegeben bekommen, bei der die Symbolschreibweise der Stoffe angegeben ist. Meist stimmt aber Anzahl der Atome nicht - man sagt dann "Die Reaktion ist nicht ausgeglichen". Die Aufgabe ist es dann, passende stöchiometrische Faktoren zu den gegebenen Stoffe zu finden, damit die Reaktionsgleichung stimmt, also ausgeglichen ist.
Dabei fängt es mit leichten Übungen an und wird immer schwerer. Zum Schluss sollst du aus einem Text, der eine Reaktion beschreibt, die Reaktionsgleichung in Symbolschreibweise aufschreiben und ausgleichen.
Anhand von drei Beispielen wird in einem 15px Video gezeigt auf was zu achten ist.
| Zum Ausgleichen einer Reaktionsgleichung dürfen nur Stöchiometrische Faktoren ergänzt werden, um die Anzahl der Atome auszugleichen. Die Formeln der Stoffe müssen unverändert bleiben, da es sich sonst um andere Stoffe handelt. |
ACHTUNG: Es ist wichtig, ob eine Zahl als Index oder stöchiometrischer Kooeffizient ergänzt wird. Dazu ein paar Beispiele!
| 2 Cl | = | 2 einzelne Chloratome. |
| Cl2 | = | 1 Teilchen, wie es im Chlorgas vorkommt, das aus 2 verbundenen Chloratomen zusammengesetzt ist. |
| H2O | = | 1 Teilchen (Molekül), das jeweils aus 2 Wasserstoffatomen und 1 Sauerstoffatom besteht. |
| 2 HO | = | 2 Teilchen, die jeweils aus 1 Wasserstoffatom und 1 Sauerstoffatom bestehen. |
| Cu2O | = | 1 Einheit vom rotem Kupferoxid, die jeweils zwei Kupferatom enthalten. Also hat man 2 Kupferatome. |
| 2 CuO | = | 2 Einheiten vom schwarzen Kupferoxid, die jeweils ein Kupferatom enthalten. Also hat man auch 2 Kupferatome. Die Veränderung des Index würde zu einem anderen Stoff führen! |
Beispiel einer Reaktionsgleichung: Das Ausgleichen der Reaktion Natrium reagiert mit Wasser unter der Bildung von Wasserstoff und Natriumhydroxid ist nicht ganz so einfach. Hier noch einmal, warum man etwas ändern muss, was man nicht machen darf und wie es dann richtig ist. Kontrolliert für euch, was noch falsch ist!
- Nach dem Aufschreiben der Edukte und Produkte in Symbolschreibweise ist die Reaktionsgleichung meist noch nicht ausgeglichen:
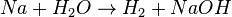
- Falsch wäre es, die Formel eines Stoffes zu verändern, auch wenn dann die Anzahl der Atome rechts und links stimmt.
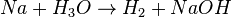
- Richtig ist es, wenn man nur stöchiometrische Faktoren ergänzt:
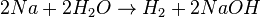
30px Aufgabe 4
Nun sollst du Reaktionen selber ausgleichen. Die Aufgaben sind als Lückentexte gegeben, in denen du die Ergebnisse eintragen sollst. Teil 1 enthält ganz einfache Aufgaben zum Einstieg. Teil 2 besteht aus leicht schwereren Reaktionsgleichungen. Denk immer daran: Wenn du nicht auf Anhieb die richtigen Faktoren findest, solltest du nicht einfach herumprobieren, sondern es systematisch angehen. Schreibe die Reaktionsgleichung im Heft auf, zähle die Atomsorten auf, verwende Zahlen für die Faktoren und trage die Faktoren auch beim Zählen ein. |
Schwere Reaktionsgleichungen vervollständigen
Nun etwas schwerer: Bisher sind die Reaktionsgleichungen recht einfach. Schwer wird es dann, wenn eines der Elemente in sehr vielen der beteiligten Stoffe auftaucht.
Dazu wieder ein 15px Video in dem ein sehr kompliziertes Beispiel gezeigt wird.
Tipps zum Ausgleichen von Reaktionsgleichungen
|
30px Aufgabe 5
Gleiche die Reaktionsgleichung Sauerstoff sollte als letztes ausgeglichen werden. Ob man mit Eisen oder Schwefel zuerst anfängt beim Ausgleichen ist nicht so wichtig. Beides geht, aber es ist trotzdem nicht so einfach, da man ein paar Mal "Nachbessern" muss um zur Lösung zu kommen. 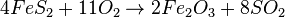 |
Zur Kontrolle zum zum Herumprobieren bei Reaktionsgleichung habe ich mir eine Tabelle erstellt, die du dir herunterladen und verwenden kannst. In einem kurzen 15px Film stelle ich die Verwendung der Datei vor. Mit Hilfe der Tabelle kannst du bei der folgenden Aufgabe deine Lösungen kontrollieren.
30px Aufgabe 6
In dieser Übung gibt es zuerst ein paar kürzere Reaktionsgleichungen, die ihr per Lückentext kontrollieren könnt. Als Teil 2 Reaktionen, die ohen Lückentext-Kontrolle sind ... geht ja auch! |
Eisengewinnung im Hochofenprozess
Um euch ein wenig Ruhe von der Theorie zu gönnen, gibt es nun ein etwa praktischeres Thema. Nach der Bronzezeit kam ja die Eisenzeit. Die Bronze hatte zwar große Vorteile gegenüber den davor verwendeten Materialen Stein und Holz, aber da Bronze zu weich ist, kann man damit zum Beispiel keine Stein bearbeiten.
Zur Einstimmung könnt ihr euch ein paar Filme zur Eisengewinnung anschauen. Aber bitte in der Schule nur, wenn ihr mit allen anderen Aufgaben fertig seid. Sonst bitte zu Hause!
- WICHTIG 15px Vom Erz zum Stahl Film aus der Planet-Wissen-Reihe (wichtig sind vor allem die Teil-Filme von 2:20 bis 13:13)
- 15px Schulprojekt zum Bau eines Rennofens (11 min) ... so wurde es früher gemacht!
- 15px Sendung mit der Maus - Stahl (14 min) ... chemisch etwas oberflächlich.
- 15px Made in Germany | Hochofen - Neustart im Stahlrevier (4 min) ... über den Bau eines mordernen Hochofen
- Rund-um-Blick in der Abstichhalle von einem alten Hochofen
30px Aufgabe
Lies dir die Informationen zur Eisenherstellung im Buch durch:
|
Reaktionsgleichungen aufstellen
30px Aufgabe
Stelle die Reaktionsgleichung für die Reaktion von |
Im Gegensatz zu den bisherigen
Die Chemie bei der Stahlgewinnung
Stahlarten
Wer Interesse (und Zeit) hat, kann sich mit den verschiedenen Arten an Stahl in einer virtuelle Stahlschmiede beschäftigen.
- Schwert, Schraubenschlüssel, Bratpfanne - Stahl ist nicht gleich Stahl. Eisen- und Stahlsorten haben sehr verschiedene Eigenschaften. Der Kohlenstoffgehalt und die Art der Legierung bestimmen, ob ein Stahl hart, zäh, verformbar, verschleißfest, elastisch oder rostfrei ist. Welcher Stahl für ein Produkt der richtige ist, lässt sich mit dem virtuellen Stahllabor ermitteln. → zur Interaktive Stahlschmiede
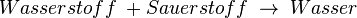
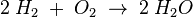
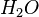 ... die 2 hinter dem H bedeutet, dass in diesem Teilchen 2 Wasserstoffatome und (weil hinter dem O nichts steht) ein Sauerstoffatom enthalten sind.
... die 2 hinter dem H bedeutet, dass in diesem Teilchen 2 Wasserstoffatome und (weil hinter dem O nichts steht) ein Sauerstoffatom enthalten sind.
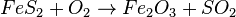 so ausführlich wie im Film mit verschiedenen Farben aus. Lass beim Aufschreiben im Heft genügend Platz vor den Stoffen in der Gleichung und beim Notieren der Anzahl unter der Gleichung! Und du wirst viel Platz brauchen!!
so ausführlich wie im Film mit verschiedenen Farben aus. Lass beim Aufschreiben im Heft genügend Platz vor den Stoffen in der Gleichung und beim Notieren der Anzahl unter der Gleichung! Und du wirst viel Platz brauchen!!

