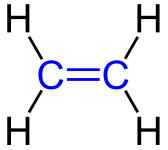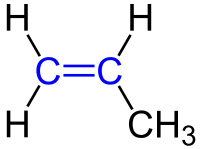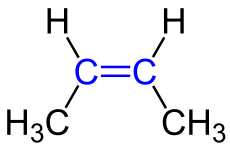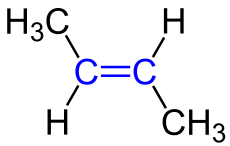Halogenalkane - ihre Bedeutung und Probleme
Inhaltsverzeichnis |
Chlor ist ein typisches Beispiel für Chemie!?
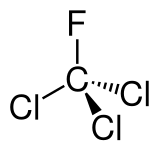
Das möchte man meinen, denn das sehr reaktive Chlor kommt natürlich meist nur als Chlorid-Ionen vor und alles andere hat die Chemie-Industrie geschaffen. Und die Liste mit den Negativbeispielen aus der industriellen Chlorchemie ist lang. Viele Chlorprodukte, vor allem Chloralkane und andere Chlorkohlenwasserstoffverbindungen sind in Verruf geraten, weil sie Krankheiten auslösen und die Umwelt gefährden.
Ein paar Beispiele gefällig?
- Insektenbekämpfungsmittel wie
 Lindan und
Lindan und  DDT (Dichlordiphenyltrichlorethan) ebenso wie die für viele Zwecke eingesetzten
DDT (Dichlordiphenyltrichlorethan) ebenso wie die für viele Zwecke eingesetzten  polychlorierten Biphenyle (PCB) haben sich in der Nahrungskette angereichert und sind sogar im Fettgewebe von weit weg von den Menschen lebenden Pinguinen nachgewiesen worden.
polychlorierten Biphenyle (PCB) haben sich in der Nahrungskette angereichert und sind sogar im Fettgewebe von weit weg von den Menschen lebenden Pinguinen nachgewiesen worden.
- Wird das Holzschutzmittels Pentachlorphenol (PCP) verbrannt entstehen giftige, krebsauslösende Dioxine.
- Die Ozonschicht wird durch die, als Kühl- und Treibmittel eingesetzten
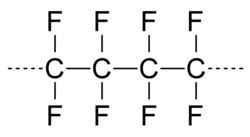
 Fluorchlorkohlenwasserstoffe (FCKW), zerstört. Immerhin hat man das schon erkannt und Konsequenzen gezogen.
Fluorchlorkohlenwasserstoffe (FCKW), zerstört. Immerhin hat man das schon erkannt und Konsequenzen gezogen.
Erstaunlicherweise ist es aber nicht nur der Mensch, der solche giftigen und gefährlichen Halogenalkane produziert. Man hat zwar schon 1934 entdeckt, dass es sich bei dem 30 Jahre zuvor gewonnenen Flechtenstoff Diploicin um einen chlorhaltige Naturstoff handelt. Aber der wurde damals als exotisch empfunden.
Inzwischen kennt man etwa 900 natürlich vorkommende Organochlorverbindungen. Produziert werden diese vor allem Bakterien, Pilze und Meeresalgen. Bei einigen Verbindungen sieht die chemische Industrie blass gegenüber den natürliche Produzenten aus. So gelangen aus natürlichen Quellen jährlich etwa fünf Millionen Tonnen Chlormethan in die Luft - größtenteils das Werk von Algen und holzabbauenden Pilzen: Das entspricht etwa einem Viertel des Chlorgehaltes der Erdatmosphäre. Das Chlormethan soll dort eine Rolle bei den jahreszeitlichen Schwankungen der Ozonschicht über den Polen spielen. Die jährlich etwa 30 000 Tonnen produziertes Chlormethan aus der industriellen Produktion sehen dagegen recht bescheiden aus.
Warum die Natur diese Stoffe herstellt konnte man inzwischen erklären. Es gibt verschiedene Gründe: So fand man heraus, dass der Einbau eines Chloratoms an einer ganz bestimmten Stelle in einem Molekül, die biologische Wirkung des chlorfreien Moleküls steigern kann. Ein Beispiel ist das in Erbsen vorkommende Wuchshormon Chlorindolessigsäure, das den Wachstum der Pflanzen stärker anregt als sein nichtchlorierter Verwandter. Der Nutzen für die Pflanze liegt letztlich darin, dass sie wegen der besseren Wirksamkeit weniger Hormon produzieren muss.
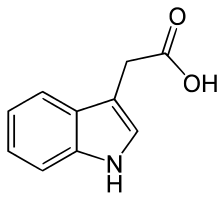
Die
 Indol-3-essigsäure ist ein in Pflanzen natürlich vorkommendes
Indol-3-essigsäure ist ein in Pflanzen natürlich vorkommendes  Phytohormon das schon in kleinsten Mengen stimulierend auf das Wachstum von Pflanzen und deren Wurzeln wirkt.
Phytohormon das schon in kleinsten Mengen stimulierend auf das Wachstum von Pflanzen und deren Wurzeln wirkt.
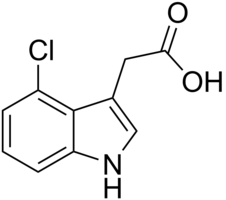
Die 4-Chlor-indol-3-essigsäure
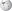 findet man bei Erbsen und ist wirksamer als die nicht-chlorierte Variante.
findet man bei Erbsen und ist wirksamer als die nicht-chlorierte Variante.
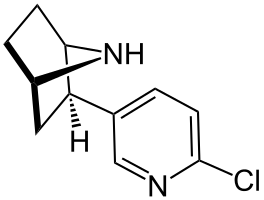
Auf der anderen Seite setzen viele Organismen solche, für andere Lebewesen giftige Chlorverbindungen, als chemische Waffe im täglichem Kampf um ihr Leben ein. Interessant ist das für den Menschen, da Arzneimittelforscher schon zahlreiche sehr wirksame Medikamente gefunden haben, die letztendlich auf Naturstoffen beruhen. Ein wirksames Breitbandantibiotikum ist z.B. das von Bakterien gebildete Chloramphenicol, das mittlerweile synthetisch hergestellt wird. Es tötet Salmonellen und viele andere Krankheitserreger ab. Im Drüsensekret eines südamerikanischen Pfeilgiftfrosches wurde vor nicht all zu langer Zeit eine medizinisch vielversprechende chlorhaltige Substanz, das ![]() Epibatidin , nachgewiesen, das etwa 200mal wirksamer ist, als das Schmerzmittel Morphin. Zwar ist das Epibatidin|Epibatidin zu ungesund für den Mensch, aber man hat daraus das ähnliche und den inzwischen zugelassenen Wirkstoff Tebanicline entwickelt.
Epibatidin , nachgewiesen, das etwa 200mal wirksamer ist, als das Schmerzmittel Morphin. Zwar ist das Epibatidin|Epibatidin zu ungesund für den Mensch, aber man hat daraus das ähnliche und den inzwischen zugelassenen Wirkstoff Tebanicline entwickelt.
Nun haben wir zahlreiche Beispiele mit Chlor als Atome in organischen Verbindungen kennengelernt, aber auch Brom und Iod-Verbindungen gibt zahlreiche in der Natur.
Der Schwamm Dysidea dendyi (im Bild ein Verwandter names Dysidea granulosa) produziert bromierte
 Dioxine .
Dioxine .
Diese ganzen Beispiele erscheinen sehr exotisch, aber auch einheimische Pflanzen liefern einen messbaren Beitrag und tragen damit zur Schädigung der Ozonschicht bei. So produzieren Kreuzblütengewächse zum Beispiel Raps Brommethan. Allein durch den deutschlandweit angebauten Raps werden etwa 6600 Tonnen im Jahr produziert, das sind 15 Prozent der Menge, die immer noch industriell hergestellt wird. Und einige immergrüne Bäume wie Tannen oder Kartoffeln synthetisieren das schon erwähnte Chlormethan.
- Einheimische Chlormethan-Produzenten
Bei all diesen Mengen an natürlich produzierten Halogenorganische Verbindungen scheint klar zu sein, dass es natürliche Abbauwege geben muss. Wie man inzwischen weiß, ist die Voraussetzung dazu eine optimale Kombination an Bedingungen und die Arbeitsteilung von spezialisierte Mikroorganismen, die die eigentlich wenig reaktiven und schwer wasserlöslichen Halogenorganische Verbindungen "verdauen" können. Natürlich ist das für Umweltchemiker von Interesse!
Gleichzeitig muss man aber bei der Festlegung von Grenzwerten für Halogenorganische Verbindungen die in der Umwelt das natürliche Vorkommen Mengen berücksichtigen, man darf sich aber nicht davon verführen lassen, diese Verbindungen zu verharmlosen, da die von uns produzierten Mengen nicht so schnell natürlich abgebaut.
Eigenschaften und Benennung der Halogenalkane
Systematische Benennung
Warum verwendet man denn Halogenalkane?
Die Frage ist wichtig, denn fast alle Halogenalkane sind nicht gerade gesund und haben vielfältige negative Auswirkungen auf die Umwelt. Auch wenn der Mensch nicht der einzige Produzent ist, so haben wir doch die Menge an produzierten Halogenalkanen erheblich erhöht. Teilweise auch mit drastisches Auswirkungen.
Wir schauen uns drei Anwendungsgebiete bzw. konkrete Produkte genauer an und informieren uns auch darüber, warum sie für ihr Anwendungsgebiet nutzbar sind.
|
Informiert Euch, in Gruppen aufgeteilt, über die drei Stoffe. Es geht dabei um die typischen Eigenschaften, die sie für ihre üblichen Einsatzwecke nutzbar machen und was chemisch dahinter steckt. Dazu müsst ihr keine ausführliche Erklärungen geben sondern nur chemische Reaktionen nennen, die ggf. beim Einsatz/Wirkung/Nebenwirkung stattfinden. Dabei geht es nur um die Verbindungen selber und was mit ihnen passiert. Folgereaktionen sind nicht erwünscht sondern sollte als kurze Beschreibung zusammengefasst werden. |
Informationsquellen könnten zum Beispiel die folgenden Wikipedia-Seiten sein:
Natürlich könnt ihr auch andere Seiten/Artikel anschauen.
Schmelz- und Siedetemperaturen
Die Schmelz- und Siedetemperaturen sind bei einigen der Anwendungsgebiete der Halogenalkane durchaus von Bedeutung. Wir kennen bereits einige Auswirkungen des Molekülbaus von speziellen Gruppierungen auf die Siedetemperatur von Stoffen. Wichtig ist dabei zum Beispiel auch die Polarität der Molekülverbindungen. Denn polare Moleküle ziehen sich an und daher werden dadurch die Schmelz- und Siedetemperaturen höher.
|
Betrachte verschiedene Halogenalkane im Online-3D-Molekül-Service molview.org und lass dir die Polarität anzeigen. Dabei gehst du folgendermaßen vor:
|
Hier eine Darstellung der Siedetemperaturen von 1-Halogenalkanen, d.h. es gibt immer nur ein Halogenatom, dass an einem der zwei äußersten Kohlenstoffatome sitzt.
|
Löslichkeit der Halogenalkane
Reaktivität bzw. Stabilität der Kohlenstoff-Halogenverbindung
Herstellung von Halogenalkanen
Zunächst einmal erscheint es nicht schwer ein Halogenalkan herzustellen. So müsste man ja nur ein Wasserstoff-Atom durch das gewünschte Halogen-Atom ersetzen. Nur ist das eben doch nicht so einfach. Der übliche Weg ist über die ungesättigten Kohlenwasserstoff Alkene und Alkine. An die Doppel- bzw. Dreifachbindung wird dann etwas addiert (also dazu genommen) und nicht substituiert (also ersetzt).
Deshalb werfen wir noch einen kleinen Blick auf die Benennung der Alkene, um dann zu klären, wie eine solche Addition an eine Doppelbindung abläuft.
Alkene ... die Superstoffe der Chemie
Aufgrund der recht reaktiven Doppelbindung sind Alkene wichtige Ausgangsstoffe für viele andere Grundstoffe der chemischen Industrie.
Alkene werden nicht zur Herstellung von Halogenkohlenwasserstoffen, Alkoholen, ![]() Ketone ,
Ketone , ![]() Glycolen , Kunststoffen und Tensiden (Waschmittel) gebraucht. Propen ist auch Ausgangsstoff zur Synthese von so wichtigen Chemikalien wie z. B. Glycerin, Phenol, Isopropylalkohol (Reinigungsalkohol), Epoxidharzen (Kleber) verwendet und Polypropylen.
Glycolen , Kunststoffen und Tensiden (Waschmittel) gebraucht. Propen ist auch Ausgangsstoff zur Synthese von so wichtigen Chemikalien wie z. B. Glycerin, Phenol, Isopropylalkohol (Reinigungsalkohol), Epoxidharzen (Kleber) verwendet und Polypropylen.
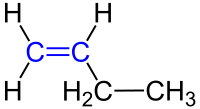
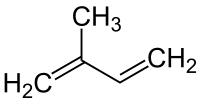
Bei der Benennung gibt es zwei Dinge zu beachten: einmal die Position der Doppelbindung in der Molekülkette und zweitens wie die Stellung der weiteren C-Atome rund um die Doppelbindung ist.
1. Position der Doppelbindung:
| Die Position der Doppelbindung in der Kohlenstoffkette wird durch eine Zahl angegeben, die das Kohlenstoffatom bezeichnet, an dem die Doppelbindung beginnt. Die Doppelbindung gilt dabei als funktionelle Gruppe und muss für die Reihenfolge der Nummerierung berücksichtigt werden, also eine möglichst kleine Ziffer erhalten.
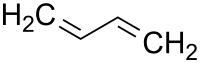
Bei Molekülen mit mehreren funktionellen Gruppen (außer der Doppelbindung) wird die Zahl direkt vor das -en gestellt. Mehrfache Doppelbindungen erhalten vor das Vorsilbe das entsprechende griechische Zahlwort gestellt. |
Hier ein paar Beispiele:
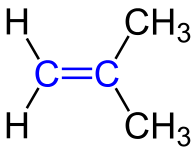
2. Anordnung um die Doppelbindung:
| Man unterscheidet die cis-Anordnung spricht man, wenn sich die beiden anhängenden Reste auf der gleichen Seite der Doppelbindung befinden und
und von einer trans-Anordnung spricht man, wenn sich die beiden anhängenden Reste auf verschiedenen Seiten der Doppelbindung befinden. Es man spricht deshalb von einer cis-trans-Isomerie, wenn sich zwei Moleküle nur aufgrund der Anordnung um die Doppelbindung unterschieden. |
cis- und trans-Isomere unterscheiden sich übrigens nicht nur im Namen sondern auch in den chemischen und physikalischen Eigenschaften wie zum Beispiel Schmelz. und Siedetemperatur und auch Reaktivität.
|
Erkläre die höheren Schmelz- und Siedetemperaturen bei den cis-Isomeren im Vergleich zu den entsprechenden trans-Isomeren mit Hilfe der Van-der-Waals-Kräfte - (fehlt) GeoGebra-Arbeitsblatt |
Elektrophile Addition
Bei der Elektrophile Addition handelt es sich um ein typische Reaktion der Organischen Chemie, die man als Standard-Reaktion oder "Muster" verstehen kann. Es ist keine Reaktion, die nur typisch für bestimmte Stoffe sondern Stoffklassen ist. Dabei geht es hier um eine Additions-Reaktion, die bei Alkenen und Alkinen als dem einen Reaktionspartner stattfinden kann und einem Elektrophil, einem elektronenliebenden Teilchen.
Die Kenntnis um solche Standard-Reaktionen (![]() Reaktionsmechanismen und
Reaktionsmechanismen und ![]() Namensreaktionen ) ermöglicht die gezielte Synthese von fast beliebigen Produkten.
Namensreaktionen ) ermöglicht die gezielte Synthese von fast beliebigen Produkten.
Von der Elektrophile Addition gibt es verschiedene Varianten, je nach Elektrophil. Wir betrachten zwei einfache, bei denen Halogenalkane die Produkte sind.
Addition von Halogenen an Alkene
Zusammengefasst kann man die Addition von Halogenen an ein Alken so darstellen:
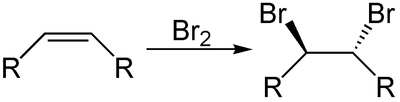
Die Doppelbindung wird aufgebrochen und die freiwerdenden Elektronen an den beiden C-Atomen verbinden sich mit je einem der Halogenatome aus dem Halogenmolekül.
Tatsächlich verläuft die Reaktion in Abschnitten, die man dank moderner Untersuchungsverfahren sehr genau bestimmen konnte. Der tatsächliche Ablauf sieht dann so aus:
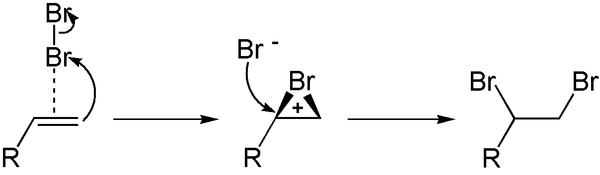
Ein Elektrophile Addition verwendet man übrigens auch als Nachweis-Reaktion:
| Die Entfärbung von Bromwasser durch einen Kohlenwasserstoff kann als Nachweis von Doppelbindungen betrachtet werden. |
Addition von Halogenwasserstoffen
Auch Halogenwasserstoff können an Doppelbindungen addiert werden. Da das angreifende Molekül zwei verschiedene Atome hat, könnte der Angriff des Halogenwasserstoffs auf zwei Arten geschehen. Die Reaktion findet mit dem folgenden Zwischenschritt statt.
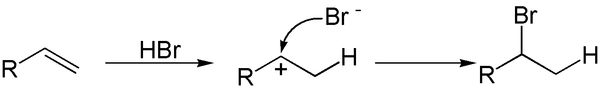
|
Aus dieser Reaktion ergeben sich zwei Fragen:
|
Kritisches zu den Halogenalkanen
|
Informiere dich im Artikel über PFCs. Neben dem Artikel solltest du auch folgendes genauer recherchieren, nutze dazu auch die auf der Seite angegebenen Links. Bereite den Vortrag vor, indem du auch die folgenden Fragen beantwortest:
|
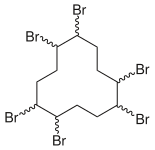
Informiere dich im Artikel über das Flammschutzmittel HBCD. Bereite den Vortrag vor, indem du auch die folgenden Fragen beantwortest:
|
Quellen im Internet
Interessante Artikel zur Halogenverbindungen
- Halogenalkane einige Beispiel für wichtige Halogenalkane und wie man sie einsetzen kann.
- Halone als Löschmittel
- Dichlordifluormethan, ein bekannte Kälte- und Treibmittel
- Im Artikel zum Ozonloch gibt es Hinweise auf natürlich vorkommende Halogenverbindungen.
- Die Natur erfand die Chlorchemie - auf Welt.de
- Umweltgifte vom Gabentisch der Natur (Spektrum der Wissenschaften)
- Schadstoffe in Flammschutzmittel
- Umweltfreundliche Klimaanlagen in Bussen
News
- Chemisch verändertes Insulin ist schneller verfügbar .... dabei geht es um Insulin, bei dem ein Wasserstoffatom durch ein Iodatom ersetzt wurde.