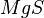Von der Saline zum Kochsalz - Nachtrag
Inhaltsverzeichnis |
Wiederholung und Vertiefung
Chemische Reaktionen im Atommodell
WICHTIGE BEGRIFFE:
|
| Chemische Reaktion im Atommodell: Es findet bei einer chemischen Reaktion nur eine Umlagerung von Atomen statt. Atome werden bei chemischen Reaktionen weder neu erzeugt noch gehen sie verloren. |
| Atomsymbol = Ein oder zwei Buchstaben, mit der man ein bestimmtes Element bzw. ein Atom dieses Elementes beschreiben kann. Enthält ein Symbol zwei Buchstaben, so ist der zweite Buchstabe immer klein. |
Chemische Reaktionen verschieden darstellen
Folgende Übungen stehen zur Verfügung:
- Übe die Symbole für die Elemente
- Kennst du die wichtigsten Stoffe?
- Unterscheide: Verbindung oder Element
- Unterscheide: Atom oder Molekül
- Verstehst du die Symbolschreibweise?
Mineralwasser enthält Ionen
|
Geladene "Atome" im Mineralwasser - Was ist das? von: B.Lachner |
Das Mineralwasser hat seine Ionen aus dem Boden und dem Gestein der Erde. Die "Mineralien" sind Verbindungen, die Ionen enthalten und da sie Wasserlöslich sind, lösen sich sich auch im Grundwasser. Eines der typischen Verbindungen mit Ionen ist Salz.
| Das, was man umgangssprachlich als Salz bezeichnet, nennt der Chemiker Natriumchlorid.
Salz ist eine Bezeichnung für eine Gruppe von chemischen Stoffen, die alle sehr ähnliche Eigenschaften haben, weil sie Ionen enthalten. Das Natriumchlorid, auch Kochsalz genannt, ist dabei in typischer Vertreter die Na und Cl enthält. |
|
Edelgasregel kennenlernen und nutzen von: B.Lachner |
| Edelgasregel: Die meisten Ionen der Hauptgruppen nehmen Elektronen auf oder geben welche ab, um die gleiche Elektronenkonfiguration wie benachbarte Edelgase zu erreichen.
Offensichtlich stellt diese Anzahl einen stabilen Zustand dar, denn Edelgase sind sehr reaktionsträge und bilden fast keine Verbindungen. |
Bestimme den Namen und die Formel von beliebigen Ionenverbindungen
Da wir mit Hilfe der Edelgasregel vorhersagen können, wie die Ladung von Ionen ist, können wir auch alleine aufgrund der beteiligten Elemente die Summen-Formel der Verbindung bestimmen. So müssen wir sie nicht auswendig lernen. Aber
|
ACHTUNG: Die Edelgasregel gilt nur für Hauptgruppen-Elemente! |
Zur Erinnerung: Systematische Benennung
| Die Anzahl der einzelnen Atome in einer Verbindung wird durch einen Index (kleine, tiefergestellte Zahl hinter dem Symbol) angegeben. Die Zahl "1" als Index wird üblicherweise weggelassen. |
Beispiele für die Symbolschreibweise wichtiger Verbindungen:
| Wasser | = | H2O | ... enthält Moleküle, die aus 2 Wasserstoffatomen und 1 Sauerstoffatom bestehen. |
| Wasserstoffperoxid | = | H2O2 | ... besteht aus 2 Wasserstoffatomen und 2 Sauerstoffatomen |
| Kohlenstoffmonoxid | = | CO | ... enthält Moleküle, die aus 1 Kohlenstoffatom und 1 Sauerstoffatom bestehen. |
| Kohlenstoffdioxid | = | CO2 | ... besteht aus 1 Kohlenstoffatom und 2 Sauerstoffatomen |
| Ammoniak | = | NH3 | ... besteht aus 1 Stickstoffatom und 3 Wasserstoffatomen |
| Kochsalz | = | NaCl | ... enthält Natrium- und Chloratome im Verhältnis 1:1 |
|
Fülle den Lückentext aus und gibt an, aus wievielen Atomen einer Sorte die Formeln der Verbindungen bestehen. |
| Die Reihenfolge der Atomsymbole in den Formeln der Verbindungen richtet sich nach der Stellung im Periodensystem: Das Atomsymbol, das weiter links steht, ist meist das Erstgenannte, sobald Atomsymbole untereinander stehen, wird das untere zuerst genannt. |
- Ausnahmen gibt es beim Wasserstoff, wenn er sich mit Stickstoff oder Kohlenstoff verbindet.
- Beispiele bei denen Wasserstoff hinten steht:
- NH3 = Ammoniak
- CH4 = Methan
Neben den sogenannten Trivialnamen, unter denen viele Verbindungen bekannt sind (wie die Beispiele oben), gibt es auch eine systematische Benennung, die Nomenklatur von Verbindungen, die sich aus der Symbolschreibweise ergibt.
|
Die im systematischen Namen verwendeten ersten 10 Zahlwörter heißen:
Beispiel: As2O5 heißt mit systematischem Namen Diarsenpent(a)oxid. |
|
In einem Memo-Quiz kannst du die Zahlwörter mit den Indexzahlen zusammenbringen. |
|
Welches der systematischen Bezeichnungen ist richtig? Achte in diesem Multiple-Choice-Test besonders auf die Zahlwörter. Die Elementnamen und die Endungen sind richtig! |
Das Element, das hinten steht, wird oft mit der Endung -id angegeben; teilweise unter Verwendung der Anfangsbuchstaben oder des ganzen wissenschaftlichen Namens.
Beispiele für Endungen:
|
Beispiele für die systematische Benennungen:
| Fe2O3 | Dieisentrioxid |
| CO | (Mono)Kohlenstoffmonooxid |
| AlCl3 | Aluminiumtrichlorid |
| H2O | Dihydrogenmonoxid (Chemischer Name für Wasser), aber es geht auch Dihydrogenoxid |
|
Bestimmt zu den gegebenen Formeln von Verbindungen die systematische Bezeichnung. Es gibt drei Sets von jeweils 5 Aufgaben. Bearbeitet erst eines und kontrolliert dieses, damit ihr mögliche Fehler erkennen könnt. Bearbeitet dann erst die nächsten fünf Aufgaben. Falls ihr die ersten 10 Verbindungen richtig benennt sollte das reichen. Wenn nicht bearbeitet noch die dritten 5 Aufgaben.
|
Und nun die umgekehrte Aufgabe ...
|
Bestimmt zu dem gegebenem systematischen Namen der Verbindungen die Formel. Es gibt wieder drei Sets von jeweils 5 Aufgaben.
|
Formeln bestimmen
|
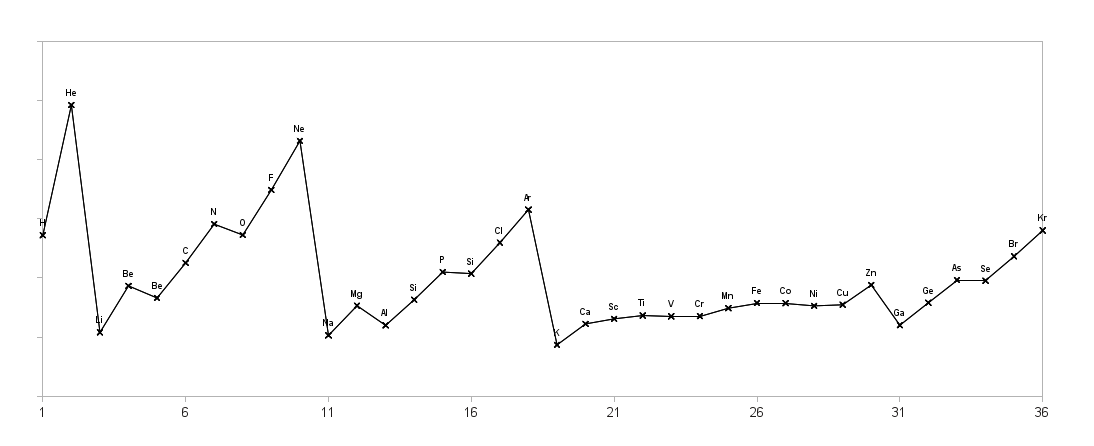
Übe die Bestimmung der Formel und Namen von Ionenverbindungen. |
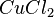 ,
, 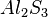 ,
, 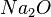 ,
, 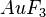 ,
, 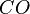
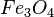 ,
, 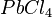 ,
, 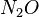 ,
, 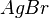 ,
, 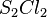
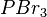 ,
, 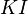 ,
, 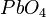 ,
, 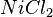 ,
, 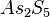
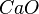 ,
, 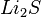 ,
, 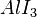 ,
, 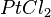 ,
, 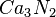
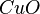 ,
, 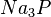 ,
, 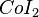 ,
, 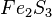 ,
, 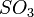
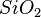 ,
, 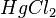 ,
,  ,
, 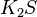 ,
,