Dalton und das erste Atommodell
Inhaltsverzeichnis[Verbergen] |
- Es ist das Streben des Naturwissenschaftlers die Natur zu verstehen. Er versucht Erklärungsmodelle zu finden, die mit denen gemachten Beobachtungen in Einklang stehen. Aber auch Abweichungen müssen damit erklärbar sein!
Schon bevor man sich intensiver über den Aufbau der Materie Gedanken machte entdeckten Chemiker einige Gesetzmäßigkeiten, die sich von leicht nachvollziehen ließen und immer noch lassen.
Die Grundgesetze der Chemie
| Zum Unterricht passende Flipchart-Datei (als PDF) |
Beim Kennenlernen des Begriffes "Chemische Reaktion" wurde bereits eine Beobachtung besprochen, die dir bekannt sein sollte:
|
Das Gesetz von der Erhaltung der Masse
Bei einer chemischen Reaktion im geschlossenen System ist die Summe der Masse der Edukte gleich der Summe der Masse der Produkte |
| VERSUCH:
... mit denen man das Massenerhaltungsgesetz überprüfen kann.
Auch bei den Experimenten 2.) und 3.) würde die Masse gleich bleiben, wenn man sie in einem großen, geschlossenen Gefäß durchführt. |
Einige Jahre später machte ein französischer Chemiker eine weitere Beobachtung, als er die Massen der Stoffe untersuchte, die bei einer chemischen Reaktion miteinander reagieren und einen neuen Stoff bilden.
|
Das Gesetz der konstanten Proportionen
|
Um seine Entdeckung nachvollziehen zu können, werden wir ein Experiment dazu durchführen. Indem mehrere Schülergruppen das Experiment nachvollziehen können wir auch sehen, dass es kein Zufallsergebnis ist.
|
Bereite dich auf das Experiment vor, indem du den Film 1 oder Film 2 anschaust. Du siehst dort, wie man das Reagenzglas erhitzen muss, damit es richtig funktioniert. |
|
Falls kein Experiment durchgeführt wird, bearbeite das folgende Arbeitsblatt (als PDF), um das Massenverhältnis von Kupfer zu Schwefel zu bestimmen. |
| VERSUCH:
|

|
Im Buch zu lesen: Zum Thema Chemische Grundgesetze findest du in unserem Buch Informationen auf Seite 140. |
Ähnliche Beobachtungen ließen sich bei verschiedenen Elementen und Verbindungen machen. Derjenige, der sich traute diese Tatsache als erster zu interpretieren war der Engländer John Dalton.
Dalton und das erste Atommodell
|
Passend ist hier ein Filmausschnitt aus dem Film Faszination Chemie (Teil 2 von 3), wo das Dalton'sche Atommodell vorgestellt wird. |
Atommodell nach Dalton:
|
Mit einfachen Experimenten, bei denen er die Massen der Edukte und Produkte wog, versuchte Dalton auch herauszubekommen, wie die sich Massen der Elemente untereinander verhalten. Wir versuchen dies in der nächsten Aufgabe für die Schwefel- und Kupferatome nachzuvollziehen.
| Als Einheit für die Atommassen verwenden wir das Symbol u (für atomic mass unit = atomare Masseneinheit). Die angegebenen Massen sind relative Atommassen. Man kann also ablesen, um wieviel schwerer ein Atom als ein anderes ist! |
- Hinweis: Die Einheit u verwendete Dalton früher nicht. Sie entspricht aber in etwa der Einheit Dalton, die damals von Dalton für die Angabe von Atommassen genutzt wurde. Wir verwenden u aber ab sofort immer, wenn wir Atommassen angeben.

|
Im Buch zu lesen: Zum Thema Dalton und sein Atommodell findest du in unserem Buch Informationen auf der Seite 135. |
|
Dalton versuchte aufgrund von quantitativen Untersuchungen die relativen Atommassen zu bestimmen. Wie könnte das Massenverhältnis der Kupfer- und Schwefelatome beim Kupfersulfid sein, wenn wir die Idee Daltons nutzen? Überlege dir zwei oder drei Möglichkeiten. Bearbeite auf dem Arbeitsblatt (PDF) nur die erste Aufgabe. |
Bei seinen Untersuchungen stellte Dalton fest, das es bei einigen Elementen mehrere Arten von Verbindungen gibt, wobei die Massen der miteinander reagierenden Elemente nicht identisch war. Hier ein paar Beispiele:

|
4 g Kupfer | + | 1 g Sauerstoff | ⟶ | 5 g rotes Kupferoxid |

|
8 g Kupfer | + | 1 g Sauerstoff | ⟶ | 9 g schwarzes Kupferoxid |

|
39 g Blei | + | 4 g Sauerstoff | ⟶ | 43 g Menninge |

|
13 g Blei | + | 1 g Sauerstoff | ⟶ | 14 g Bleiglanz |

|
13 g Blei | + | 2 g Sauerstoff | ⟶ | 15 g braunes Bleioxid |
Aber auch bei diesen Verbindungen ließ sich eine Besonderheit finden, weswegen Dalton dann das dritte Grundgesetz Chemie formulierte:
|
Gesetz der multiplen Proportionen
Die Massenverhältnisse zweier, sich zu verschiedenen chemischen Verbindungen vereinigender Elemente, stehen stets im Verhältnis einfacher ganzer Zahlen zueinander. Beispiel: In den fünf Stickoxiden stehen die auf eine bestimmte Stickstoffmenge kommenden Sauerstoffmengen im Verhältnis von 1:2:3:4:5 |
Interessanter Weise war es eigentlich nicht Dalton, der das Gesetz der multiplen Proportionen als erster entdeckte, sondern der Deutsche ![]() Jeremias Benjamin Richter . Warum Richter den Zusammenhang mit der Atomtheorie übersehen hat, bleibt rätselhaft. Vermutlich glaubte er aus philosophischen Gründen an einen anderen Aufbau der Materie.
Jeremias Benjamin Richter . Warum Richter den Zusammenhang mit der Atomtheorie übersehen hat, bleibt rätselhaft. Vermutlich glaubte er aus philosophischen Gründen an einen anderen Aufbau der Materie.
|
Bestimme für die Verbindungen von Kupfer mit Sauerstoff bzw. Blei und Sauerstoff wie bei Aufgabe 3 mögliche relative Atommassen der Elemente. Nutze das Arbeitsblatt von Aufgabe 3 und bearbeite darauf die Punkte 2.) und 3.). Versuche abschließend Werte für die relativen Atommassen von Blei, Kupfer, Schwefel und Sauerstoff zu finden, die bei allen untersuchten Verbindungen passen würden. |
![]() Tafelbild Klasse:9a, Datum:30.4.2012
Tafelbild Klasse:9a, Datum:30.4.2012
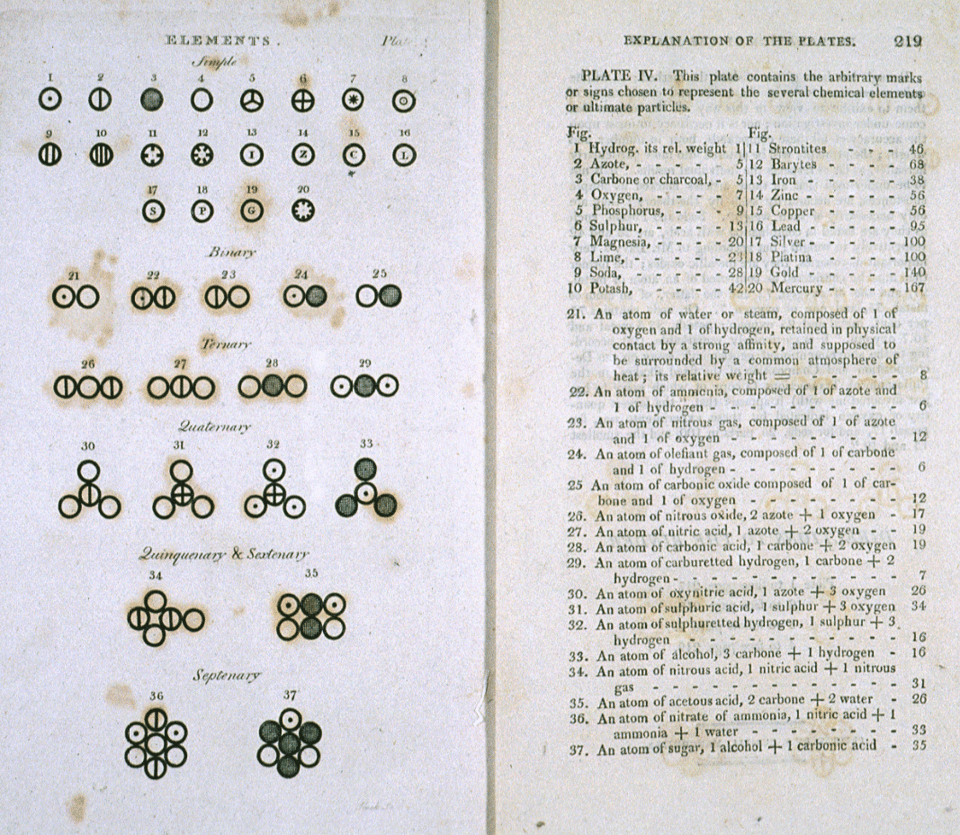
Dalton hat zahlreiche quantitative Experimente durchgeführt und versucht, wie wir es auch gemacht haben, relative Atommassen zu bestimmen. Um seine Ergebnisse über die Zusammensetzung einer Verbindung grafisch darzustellen führte Dalton Symbole ein, die bei uns aber nicht mehr gebräuchlich sind.
Ergänzung: Wie wiegt man Gas?
Wie man die Dichte von Gasen mit einfachen Mitteln bestimmen kann, wird hier gezeigt: Dichte von Gasen
Im Labor nimmt man üblicherweise Glaskolben als Gefäße. Die Gasmaus ist eine kleinere Variante aber es gibt auch runde Glaskolben mit einem Liter Inhalt, die dazu verwendet werden.
Grundprinzip, das bei allen Gasen angewendet werden kann, die schwerer als Luft sind:
- Evakuiertes Gefäß wiegen.
- Mit dem zu untersuchenden Gas gefülltes Gefäß wiegen
Aus der Differenz bekommt man das Gewicht der Gasportion.
Bei Gasen, die leichter als Luft sind, kann man dieses Prinzip allerdings nicht anwenden, denn sie würden das Gewicht des Gefäßes ja verringern oder es gar wegfliegen lassen. Möglichkeiten die man dann hat:
- Man kühlt und verflüssigt das Gas (eventuell auch mit Druck) und kann das Gewicht des Gases so direkt wiegen.
- Man betrachtet statt des Gases selber ein Reaktionsprodukt dessen Zusammensetzung gut bekannt ist und kann so zurück auf das gesucht Gas schließen.
- Man braucht eine Art Lösungsmittel für das Gas, in dem es festgehalten wird. Durch die Zunahme des Gewichtes des Lösungsmittels kann man dann bestimmen, wieviel Gas man hatte. Man nennt diese Verfahren auch Gasgravimetrie.
Ein klassisches Beispiel für die Anwendung der zweiten und dritten Variante ist die ![]() Elementaranalyse , bei der man die Zusammensetzung von organischen Stoffen untersucht. Solche organischen Stoffe enthalten sehr häufig Kohlenstoff, Wasserstoff und Sauerstoff. Bei der Verbrennung entstehen daraus die Verbennungsabgase Kohlendioxid und Wasser, die durch eine abgeschlossene Apparatur geleitet werden.
Elementaranalyse , bei der man die Zusammensetzung von organischen Stoffen untersucht. Solche organischen Stoffe enthalten sehr häufig Kohlenstoff, Wasserstoff und Sauerstoff. Bei der Verbrennung entstehen daraus die Verbennungsabgase Kohlendioxid und Wasser, die durch eine abgeschlossene Apparatur geleitet werden.
- Das entstehende Kohlendioxid wird durch Calciumchlorid geleitet, dass damit reagiert und es aufnimmt.
- Das entstehende Wasser wird durch konzentrierte Natron- oder Kalilauge geleitet, die das Wasser aufnimmt.
Man muss die Gefäße mit den beiden Chemikalien vor und nach der Untersuchung wiegen und kann dann die Mengen an Kohlendioxid und Wasser bestimmen, die entstanden sind. Aus der Menge an Wasser lässt sich, da ja das Gesetz der konstanten Proportionen gilt, bestimmen, wieviel Wasserstoff enthalten war.
Ergänzung: Irrungen und Wirrungen
Anders, als hier dargestellt, war der Weg von der Alchemie hin zur wissenschaftlich fundierten Chemie, kein direkter Weg. Es gab einige Fehler und Sackgassen, in die die Chemiker von damals gerieten. Ein wichtiger und lang sehr verbreitete Irrglaube, war der an das sogenannte ![]() Phlosgiston .
Phlosgiston .
Die Phlogistontheorie ist ein Erklärungskonzept, das den (chemischen) Prozess der Verbrennung zu erklären suchte. Phlogiston ist dabei ein postulierter Stoff oder eine hypothetische Substanz, die allen brennbaren Körpern bei der Verbrennung entweiche. Alle brennbaren Körper würden Phlogiston enthalten und bei der Verbrennung erfolgte eine Zerlegung in Phlogiston, welches flüchtig sei und entweiche, und den zurückbleibenden, phlogistonfreien und unbrennbaren Teil, der Asche.
Die Massenzunahme beim Erhitzen von Kupfer oder Eisen erklärte man so, dass man glaubte, dass Phlogiston leichter als Luft ist und mit dem Entweichen des Phlogistons quasi der Auftrieb abnimmt und der Stoff dadurch schwerer wird.
Erst Ende des 18. Jahrhunderts wurde die Phlogistontheorie durch Antoine Laurent de Lavoisiers Oxidationstheorie ersetzt, die alle von brennbaren Stoffen beobachtbaren Eigenschaften durch eine Reaktion mit dem erst kurz zuvor entdecktem Sauerstoff erklärten.