Metallgewinnung durch Elektrolyse
Inhaltsverzeichnis[Verbergen] |
Schüler-Experiment: Elektrolyse einer Kupferbromid-Lösung
| Eine Elektrolyse die Zerlegung eines Stoffes mit Hilfe von Strom. |
| VERSUCH:
Führe die Elektrolyse von Kupferiodid durch. .... |
Hier ein Zeitraffer-Video der Elektrolyse von Zinkbromid.
Was ist eigentlich elektrischer Strom und wie wirkt er sich aus?
Der Strom, den man zur Elektrolyse verwendet, ist hier von entscheidender Bedeutung. Nur wenn du weißt, was elektrischer Strom ist, kannst du die Vorgänge, die bei der Elektrolyse passieren, verstehen. Normalerweise ist das Fach Physik der eigentlich "Ansprechpartner" in Sachen Strom. Aber dies wird erst in der Physik in Klasse 10 behandelt und so arbeiten wir ein wenig vor!
|
Was ist elektrischer Strom? Schau die die folgende Animation an, bei der du einen einfachen und kleinen Stromkreislauf hast. Überlege zuerst einmal, was auf dem Bild alles zu sehen ist und beschrifte diese auf diesem Arbeitsblatt. |
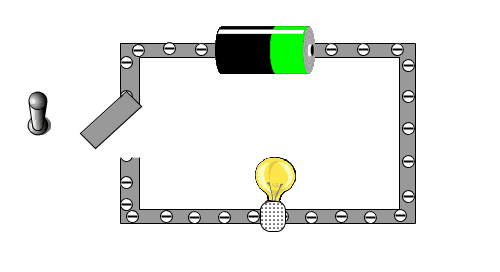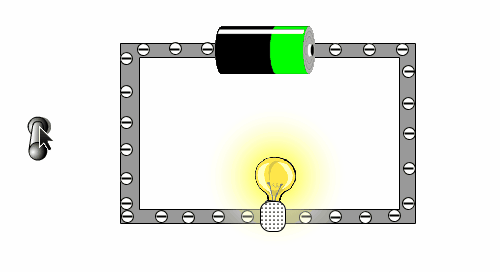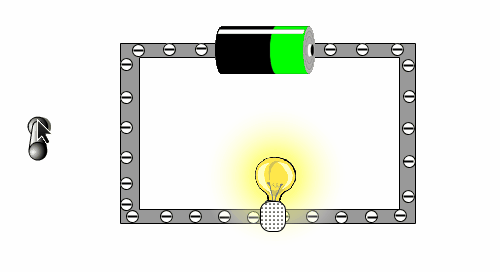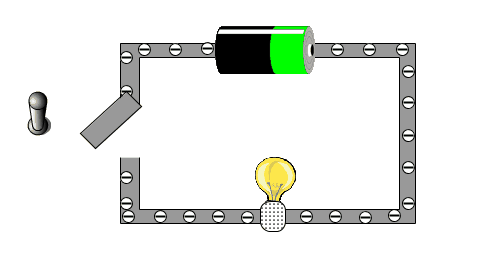
|
Nun ein paar Fragen: Klappe den folgenden Bereich auf und kreuze die Antwort an, die deiner Meinung nach am besten als Antwort passen. |
Was passiert bei einer Elektrolyse?
Eigenschaften von Ionen
|
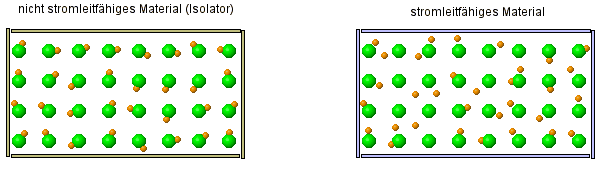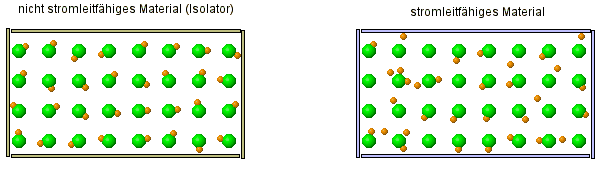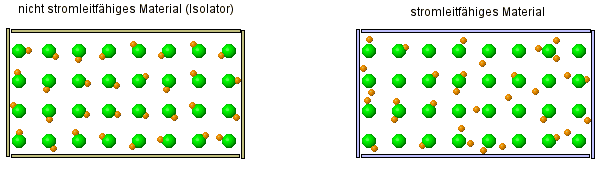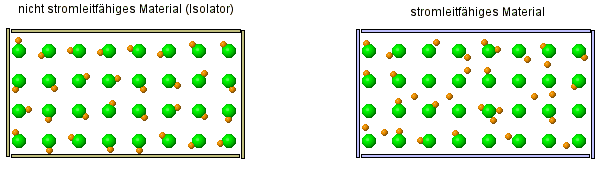
Als kleine Wiederholung ... im versteckten Bild sieht man zwei verschiedene Arten von Stoffe. Stelle Vermutung über die Eigenschaften der Stoffe an. |

|
Bestimme zu den Ionen aus dem Mineralwasser und ein paar weiteren Ionen jeweils die Anzahl der Protonen und Elektronen.
|
Übungen zur Elektrolyse
|
Aufstellen von Reaktionsgleichungen: Schreibe für die folgenden Elektrolyse-Vorgänge die Reaktionsgleichung auf.
|
|
Mineralien bestehen aus Ionen
Das erste Mal haben wir Ionen auf dem Etikett von Mineralwasser gesehen. Wie kommen eigentlich die Ionen ins Mineralwasser?
Bei Mineralwasser handelt es sich ja um eine Art Grundwasser, das natürlich auch mit Gestein in Kontakt gekommen ist. Da auch Gesteine nichts anderes sind als Vermischungen von Mineralien (= Salze bzw. salzartige Verbindungen), stammen die Ionen also aus den Salzen, die sich im Wasser gelöst haben. Hier mal einige (einfache) Salze. Die Namen sollten euch bekannt sein:
Auch sogenannte Gesteinsarten, die nicht so hübsch aussehen, enthalten Mineralien, nur eben vermischt.
| Als Gestein bezeichnet man eine feste, natürlich auftretende, in der Regel mikroskopisch heterogene Vereinigung von Mineralen, Gesteinsbruchstücken, Gläsern oder Rückständen von Organismen.
|
Hier zwei Beispiele:
Die Formeln dieser Verbindungen sind teilweise ziemlich kompliziert und lassen sich nicht nach unseren Regeln benennen!
Allerdings sind nicht alle Verbindungen, die ihr schon kennengelernt habt, Salze. So sind Wasser und Zucker keine Verbindungen, die Ionen enthalten . Man sollte sich merken:
| Salze bzw. salzartige Verbindungen enthalten fast immer Ionen von Metallen und Nichtmetallen, wobei es Metall-Kationen und Nichtmetall-Anionen sind. |
- Neben Ionen aus einzelnen Atomen gibt es auch Ionen, die aus mehreren Atomen zusammen gesetzt sind, wie auf dem Mineralwasseretikett das Sulfat- (SO42-) oder das Hydrogencarbonat-Ion (HCO3-).
- Es gibt auch das Ammonium-Ion NH4+, dass statt eines Metall-Ions enthalten sein kann.
Die Tatsache, dass man den Verbindungen aus Ionen einen gemeinsamen Namen, also Salze, gegeben hat, kommt nicht nur von den Ionen. Sie haben auch viele gemeinsame Eigenschaften:
- Salzartige Verbindungen bilden fast immer Kristalle mit scharfen Kanten und glatten Flächen. Das sieht man bei den Bildern oben.
- Sie haben meist sehr hohe Schmelz- und Siedetemperaturen. z.B. Kochsalz Smt.: 804°C Sdt.: 1465°C
- Sie sind spröde, d.h. beim Versuch sie zu Verformen zerbrechen sie.
- Sie sind meist gut im Wasser löslich.
- Salzlösungen leiten den Strom, ebenso Salzschmelzen. Das feste Salz dagegen leitet nicht den Strom und ist ein Isolator.

|
Im Buch zu lesen: Zum Thema Eigenschaften von Salzen findest du in unserem Buch Informationen auf 202 und 203. |
|
Lies im Buch die Seiten 202 und 203 durch und finde Erklärungen, wie sich die Eigenschaften von salzartigen Verbindungen mit Hilfe der vorhandenen Ionen erklären lassen. |