Heizen und Antreiben: Unterschied zwischen den Versionen
(→Kugelwolkenmodell und Lewisschreibweise) |
(→Warum wird bei Reaktionen mit Atombindungen Energie frei?) |
||
| (15 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 349: | Zeile 349: | ||
<center>[[File:Molekül-Baukasten gesamt.jpg|600px]]</center> | <center>[[File:Molekül-Baukasten gesamt.jpg|600px]]</center> | ||
| − | Die Atome haben eine genau festgelegte Anzahl an Anschlüssen, die sich aus der Verteilung der Elektronen im Kugelwolkenmodell ergibt. Hier einige, die im Baukasten bei uns vorkommen: | + | Die Atome haben eine genau festgelegte Anzahl an Anschlüssen, die sich aus der Verteilung der Elektronen im Kugelwolkenmodell ergibt. Hier einige Atome, die im Baukasten bei uns vorkommen: |
<gallery style="text-align:center" mode="packed" widths="150" heights="120"> | <gallery style="text-align:center" mode="packed" widths="150" heights="120"> | ||
| − | File:Molekül-Baukasten-Kohlenstoff-Atom.png|'''Kohlenstoff'''-Atom | + | File:Molekül-Baukasten-Kohlenstoff-Atom.png|'''Kohlenstoff'''-Atom im Baukasten ... |
| − | File:Molekül-Baukasten-Sauerstoff-Atom.png|'''Sauerstoff'''-Atom | + | File:Kohlenstoff-Atom Lewisschreibweise.png|... und '''Kohlenstoff''' in Lewisschreibweise. |
| − | File:Molekül-Baukasten-Stickstoff-Atom.png|'''Stickstoff'''-Atom | + | File:Molekül-Baukasten-Sauerstoff-Atom.png|'''Sauerstoff'''-Atom im Baukasten ... |
| − | File:Molekül-Baukasten-Chlor-Atom.png|'''Chlor'''-Atom | + | File:Sauerstoff-Atom Lewisschreibweise.png|... und '''Sauerstoff''' in Lewisschreibweise. |
| + | </gallery> | ||
| + | <gallery style="text-align:center" mode="packed" widths="150" heights="120"> | ||
| + | File:Molekül-Baukasten-Stickstoff-Atom.png|'''Stickstoff'''-Atom im Baukasten ... | ||
| + | File:Stickstoff-Atom Lewisschreibweise.png|... und '''Stickstoff''' in der Lewisschreibweise. | ||
| + | File:Molekül-Baukasten-Chlor-Atom.png|'''Chlor'''-Atom im Baukasten ... | ||
| + | File:Chlor-Atom Lewisschreibweise.png|... und '''Chlor''' in Lewisschreibweise. | ||
</gallery> | </gallery> | ||
| + | |||
| + | Was aber tun, wenn du kein passendes "Atom" im Kasten hast, wie zum Beispiel bei Brom oder Phosphor? | ||
| + | |||
| + | {{Kurzregel|Fehlen Atome, so können sie ersetzt werden durch Atome der gleichen Hauptgruppe, da bei diesen die Elektronenverteilung die gleiche ist. ''(siehe Periodendensystem mit Kugelwolkenmodell und Lewisschreibweise!)'' | ||
| + | * Phoshpor P → Stickstoff N | ||
| + | * Brom Br → Chlor Cl}} | ||
Wenn alle "Anschlüsse" besetzt sind, hat jedes Molekül seinen Edelgaszustand erreicht. Hier zwei Beispiele, für Verbindungen aus Kohlenstoff und Wasserstoff, jeweils mit der Summenformel und der Lewisschreibweise dazu. | Wenn alle "Anschlüsse" besetzt sind, hat jedes Molekül seinen Edelgaszustand erreicht. Hier zwei Beispiele, für Verbindungen aus Kohlenstoff und Wasserstoff, jeweils mit der Summenformel und der Lewisschreibweise dazu. | ||
| − | <gallery style="text-align:center | + | <gallery style="text-align:center" widths="250" heights="200"> |
File:Molekül-Baukasten Methan.png|'''Methan''', mit der Summeformel CH<sub>4</sub> in Modell ... | File:Molekül-Baukasten Methan.png|'''Methan''', mit der Summeformel CH<sub>4</sub> in Modell ... | ||
File:Methane-2D-square.png|... und '''Methan''' in der Lewisschreibweise. | File:Methane-2D-square.png|... und '''Methan''' in der Lewisschreibweise. | ||
| + | </gallery> | ||
| + | <gallery style="text-align:center" widths="250" heights="200"> | ||
File:Molekül-Baukasten Ethan.png|'''Ethan''', mit der Summenformel C<sub>2</sub>H<sub>6</sub> in Modell ... | File:Molekül-Baukasten Ethan.png|'''Ethan''', mit der Summenformel C<sub>2</sub>H<sub>6</sub> in Modell ... | ||
File:Ethan Lewis.svg|... und '''Ethan''' in der Lewisschreibweise. | File:Ethan Lewis.svg|... und '''Ethan''' in der Lewisschreibweise. | ||
| Zeile 374: | Zeile 388: | ||
{{AufgabeNr|1|2=[[Datei:LCAO-Darstellung in Jmol Freie Elektronenpaare.png|right|120px]]Du sollst gleich mit dem Modellbaukasten Moleküle basteln. Überlege dir folgendes vorher noch einmal, damit du vom Modell richtig auf die Lewisschreibweise folgern kannst: | {{AufgabeNr|1|2=[[Datei:LCAO-Darstellung in Jmol Freie Elektronenpaare.png|right|120px]]Du sollst gleich mit dem Modellbaukasten Moleküle basteln. Überlege dir folgendes vorher noch einmal, damit du vom Modell richtig auf die Lewisschreibweise folgern kannst: | ||
* Was bedeuten die Anschlüsse? | * Was bedeuten die Anschlüsse? | ||
| − | * Warum sind die Anschlüsse beim Sauerstoff nicht gestreckt (also im 180° Winkel) | + | * Warum sind die Anschlüsse beim Sauerstoff nicht gestreckt (also im 180° Winkel) an der Kugel angeordnet? Für was hat man da Platz gelassen? ''Siehe auch Bild rechts!'' |
}} | }} | ||
{{AufgabeNr|2|2=Nutze den Modellbaukasten, um die folgenden Moleküle zu bauen. | {{AufgabeNr|2|2=Nutze den Modellbaukasten, um die folgenden Moleküle zu bauen. | ||
| − | * '''Bromwasserstoff''' HBr, '''Formaldehyd''' H<sub>2</sub>CO, ''' | + | * '''Bromwasserstoff''' HBr, '''Formaldehyd''' H<sub>2</sub>CO, '''Methanol''' CH<sub>3</sub>OH, '''Phosphorwasserstoff''' PH<sub>3</sub>, '''Kohlendioxid''' , '''Cyanwasserstoff''' HCN, '''Ameisensäure''' HCOOH, '''Ethanol''' C<sub>2</sub>H<sub>5</sub>OH, '''Kohlensäure''' H<sub>2</sub>CO<sub>3</sub> |
'''ACHTE DARAUF:''' Es dürfen keine Anschlüsse übrig bleiben! | '''ACHTE DARAUF:''' Es dürfen keine Anschlüsse übrig bleiben! | ||
| Zeile 395: | Zeile 409: | ||
'''TIPPS:''' | '''TIPPS:''' | ||
* Wähle in molview.org im Menü ''Model'' '''Jmol''', dass eine bessere 3D-Darstellung hat. | * Wähle in molview.org im Menü ''Model'' '''Jmol''', dass eine bessere 3D-Darstellung hat. | ||
| − | * Wähle im Menü '' | + | * Wähle im Menü ''Model'' '''van-der-Waals-Spheres''', wo du siehst, wie die kompletten überlappenden Atome von außen aussehen. |
<gallery style="text-align:center" mode="packed" widths="400" heights="200"> | <gallery style="text-align:center" mode="packed" widths="400" heights="200"> | ||
| Zeile 403: | Zeile 417: | ||
}} | }} | ||
| − | ==== | + | === Warum wird bei Reaktionen mit Atombindungen Energie frei? === |
| + | Bei Ionenverbindungen hatten wir ja schon genauer nachgeschaut, wo die Energie herkommt, die die Bildung einer Ionenverbindung zu einer exothermen Reaktion macht. Das wollen wir uns nun auch genauer anschauen bei Reaktionen, in denen Moleküle als Edukte genutzt werden oder bei einer Reaktion entstehen. | ||
| + | |||
| + | {{Kurzregel|Bei Reaktionen findet nach der '''Atom-Theorie''' von '''Dalton''' nur eine Umlagerung von Atomen statt.}} | ||
| + | |||
| + | Diese "alte" Regel gilt immer noch, auch wenn wir vom Wissen her nun weiter sind als Dalton und schon begründen können, warum Atome in Verbindungen zusammenhalten. Trotzdem findet bei Reaktionen eine Umlagerung der Atom statt. Ein einfaches Beispiel: | ||
| + | |||
| + | <center>[[File:Combustion reaction of methane.jpg|500px]]</center> | ||
| + | |||
| + | Diese Reaktion beschreibt die Verbrennung von Methan zu Kohlendioxid und Wasser. Die Reaktion ist exotherm, denn die Verbrennung von Methan ''(also quasi Ergdas)'' wird ja zum Heizen verwendet, es wird also chemische Energie in Wärme-Energie umgewandelt. | ||
| + | |||
| + | Nun muss man bei der Reaktion bedenken, dass die Entstehung z.B. von Kohlendioxid eine Zwischenstufe benötigt, die hier nicht dargestellt ist. Damit Kohlendioxid entstehen kann, muss das Methan-Molekül zerlegt werden, dass heißt, dass die Wasserstoffatome vom Kohlenstoff getrennt werden müssen. Und auch die Sauerstoff-Moleküle O<sub>2</sub> müssen zerlegt werden. Beide Änderungen benötigen Energie, denn wir haben ja festgehalten, dass die Atombindung stabil ist, das also die Atome sich dank eines gemeinsamen Elektronenpaars anziehen. Und diese Anziehung müssen wir für die Trennung überwinden, das heißt, dass es zunächst einmal ein endothermener Vorgang ist. | ||
| + | |||
| + | Wieviel Energie das Aufbrechen einer Bindung benötigt, hat man inzwischen bei vielen Verbindungen und Bindungsarten durch Messungen herausgefunden. Dazu hat man einzelne Stoffe untersucht und probiert, bei welcher Energiezufuhr (Erwärumung) die Bindungen nicht mehr halten und der Stoff in einzelne Atome zerfällt. | ||
| + | |||
| + | {{AufgabeNr|XX|Warum sind Bindungen unterschiedlich stark. Versuche verschiedenen Gründe zu finden, warum sich verschiedene Atome unterschiedlich stark anziehen?}} | ||
| + | |||
| + | Hier ein kleine Tabelle mit verschiedenen Bindungen und ihren Bindungsenergieen: | ||
| + | |||
| + | <center> | ||
| + | {| class="wikitable" style="font-size:170%; text-align:center" | ||
| + | |- class="hintergrundfarbe5" | ||
| + | | '''Bindungsart''' | ||
| + | | '''Bindungsenergie''' | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | C-H | ||
| + | | 413 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | O-H | ||
| + | | 463 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | C−C | ||
| + | | 348 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | C=C | ||
| + | | 614 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | C≡C | ||
| + | | 839 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | C−O | ||
| + | | 358 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | C=O | ||
| + | | 745 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | H−H | ||
| + | | 436 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | N≡N | ||
| + | | 945 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | O−O | ||
| + | | 146 | ||
| + | |- | ||
| + | | class="hintergrundfarbe5" | O=O | ||
| + | | 498 | ||
| + | |} | ||
| + | </center> | ||
| + | |||
| + | {{Kurzregel| | ||
| + | * Die '''Trennung von Bindungen''' erfordert Energie, weil die Anziehung der Atome in den Bindungen überwunden werden muss. | ||
| + | * Die '''Bildung von neuen Bindungen''' führt zur Abgabe von Energie, denn da die Atome sich nicht mehr bewegen können, wird die Bewegungsenergie als Wärme abgegeben. | ||
| + | }} | ||
| + | |||
| + | == Ausgleichen von Reaktionsgleichungen == | ||
Das Ausgleichen von Reaktionsgleichungen ist eine typische Übung, die in Chemie immer wieder vorkommt. Wie du schon bei den Überlegungen zur Verbrennungsenergie kennengelernt hast, ist das zum Beispiel wichtig, damit man die genaue Anzahl an Bindungen in den Molekülen kennt. Später wird es noch wichtig für Mengen-Berechnungen sein, um z.B. vorher ausrechnen zu können, wieviel man von welchem Ausgangsstoffe braucht, um eine bestimmte Menge eines Produktes zu bekommen. | Das Ausgleichen von Reaktionsgleichungen ist eine typische Übung, die in Chemie immer wieder vorkommt. Wie du schon bei den Überlegungen zur Verbrennungsenergie kennengelernt hast, ist das zum Beispiel wichtig, damit man die genaue Anzahl an Bindungen in den Molekülen kennt. Später wird es noch wichtig für Mengen-Berechnungen sein, um z.B. vorher ausrechnen zu können, wieviel man von welchem Ausgangsstoffe braucht, um eine bestimmte Menge eines Produktes zu bekommen. | ||
Aktuelle Version vom 17. April 2018, 12:53 Uhr
Heizen und Antreiben? ... was hat das mit Chemie zu tun?
Drei wichtige Aspekte, die wir bisher schon bei den anderen Themen angesprochen haben, bringen hier Chemie ins Spiel:
- Welche Stoffe eigenen sich zum Heizen und Antreiben? Was sind ihre typischen Eigenschaften, die bei der Verwendung eine Rolle spielen?
- Welche chemischen Reaktionen laufen bei der Benutzung ab?
- Können wir die Eigenschaften und die Reaktionen auf atomarer Ebene erklären?
Ein wichtiger Aspekt, der hier eine Rolle spielt, den wir bisher noch nicht so intensiv betrachtet haben, ist das Thema "Energie". Dazu eine erste Übung.
Inhaltsverzeichnis
|
Energie bei chemischen Reaktionen
30px Aufgabe 1
Bei den in den folgenden Informationen beschriebenen Vorgängen, finden immer auch chemische Reaktionen statt. Teilweise sogar zwei chemische Reaktionen. Bei allen ist die Umsetzung von Energie von großer Bedeutung.
Die Texte können mit Aufgaben als pdf hier heruntergeladen werden. |
- Die Photosynthese ist ein Prozess, bei dem Lichtenergie durch Lebewesen in chemische Energie umgewandelt wird und organische Stoffe synthetisiert werden. ... Die Synthese dieser Stoffe geht überwiegend von der sehr energiearmen anorganischen Kohlenstoff-Verbindung Kohlenstoffdioxid aus. Aus Kohlenstoffdioxid und Wasser entsteht – durch Energiezufuhr (Licht) – Traubenzucker (Glucose) und Sauerstoff.
Material 2: Chemische Energie
Verwendung chemischer Energie in technischen Systemen
- Aus technischer Sicht ist in Treibstoffen chemische Energie gespeichert, die durch deren Verbrennung, etwa beim Antrieb von Fahrzeugen, in mechanische Energie umgewandelt wird. Brennstoffzellen erlauben den Wandel von chemischen Reaktionsenergie einer Verbrennung direkt in elektrische Energie. Bei Nutzung von Batterien wird über elektrochemische Reaktionen die chemische Energie direkt in elektrische Energie gewandelt. Ein Akkumulator verhält sich bei der Nutzung der Energie ähnlich wie eine Batterie, kann aber auch umgekehrt elektrische Energie in chemische wandeln und so speichern.
Verwendung chemischer Energie in biologischen Systemen
- Aus biologischer Sicht ist in organischer Nahrung chemische Energie gespeichert, die in ATP als Energieträger umgewandelt wird. Grüne Pflanzen beziehen ihre chemische Energie nicht aus organischer Nahrung, sondern aus dem Energiegehalt der Sonnenstrahlung ...
Material 3: Bleiakku
- Bei einem Bleiakkumulator (kurz Bleiakku, besonders beim Kfz auch Starterbatterie) handelt es sich um eine Ausführung des Akkumulators, bei der die Elektroden aus Blei und der Elektrolyt aus verdünnter Schwefelsäure besteht.
- Bei der Entladung reagiert Blei mit Sauerstoff zu Bleioxid und löst sich im Elektrolyt auf. Beim Laden wird die Reaktion umgekehrt und es entsteht wieder metallisches Blei.
Material 4: Wasserstoff als Energieträger der Zukunft
- Wasserstoff scheint eines der Energieträger der Zukunft zu sein. Besonders sauber wird er hergestellt, wenn der für die Aufspaltung von Wasser in Wasserstoff und Sauerstoff benötigte Strom mit Hilfe von Solarzellen gewonnen wird.
- Wird das gasförmige Wasserstoff unter Druck verflüssigt, so kann man ihn auch in Tanks füllen und als Treibstoff verwendet werden. Dabei kann der Wasserstoff direkt mit Sauerstoff verbrannt werden oder die, in ihm enthaltene Energie, wird mit Hilfe einer sogenannten Brennstoffzelle in elektrischen Strom verwandelt werden. Und die „Abgase“? Als einziges Reaktionsprodukt entsteht Wasserdampf.
30px Aufgabe 2
Lies im Buch (Chemie heute I) die Seiten 73 und 75 bis 77 und halte die neuen Begriffe mit Definitionen fest, die mit dem Aspekt des Energieumsatzes bei chemischen Reaktionen zu tun haben.
|
30px Aufgabe 3
Um die neuen Begriffe gleich anwenden zu können gibt es ein Zuordnungsquiz. |
Energie aus physikalischer Sicht
| Bei Energie denkt man sicher zuerst an Strom. Sicher bekommt ihr mit, dass andauernd der Begriff Energie in den Nachrichten vorkommt: Energie sparen, Alternative Energie, fossile Energie, Sonnenenergie, ...
Für die Physiker ist der Begriff Energie von wichtiger Bedeutung. Auch wenn das Thema im Physik-Unterricht erst später durchgenommen wird, so solltet ihr vorab ein paar Dinge dazu wissen.
|
30px Aufgabe 5
Den physikalische Aspekt der Energieumwandlungen bei chemischen Reaktion kannst du in einem weiten Quiz noch mal anwenden, bei dem ein paar Filme vorgegeben sind. Zu jedem Film gibt es dann ein paar MultipleChoice-Fragen. |
Experimente zur Energie bei chemischen Reaktionen
30px Aufgabe 5
Führe die drei Experimente durch und betrachte die Videos zu den Experimenten, die du nicht selber durchführen kannst. Halte zu jedem Experiment die Überschrifte und Notizen über die Beobachtungen fest. Nutze dabei auch die Begriffe zum Energieumsatz bei chemischen Reaktionen, die wir besprochen haben. |
VERSUCH:
Verwende bei beiden Versuchen eine Schutzbrille! ACHTUNG: 19px Kupfersulfat ist umweltgefährdend und darf deshalb nicht in den Abfluss! Hände nach dem Experiment waschen. Versuch 1: Erhitze in einem waagrecht eingespannten Reagenzglas etwas "blaues Kupfersulfat" (= Kupfersulfat-Hydrat). Beobachte die Farbe des Pulvers bzw. deren Veränderung und die Wand des Reagenzglases im nicht erhitzten Teil. Versuch 2: Versetze in einer kleinen Porzellanschale eine Spatelspitze weißes Kupfersulfat mit wenigen Wassertropfen aus der Plastikpipette und beobachte die Veränderung von Farbe und Temperatur!
Aufräumen: Gib das erhitzte bzw. mit Wasser versetzte Kupfersulfat jeweils in das passende Behältnis und "lege" wieder alle Geräte zurück. Ein Auswaschen ist nicht notwendig. Es reicht die Reste aus zu schütten/klopfen/kratzen. |
VERSUCH:
Du sollst in diesem Experiment vergleichen, wie heftig die Reaktion verschiedener Metalle beim Verbrennen ist. Schutzbrille verwenden! Sind die Hände gewaschen? Dazu soll das Metallpulver in die Bunsenbrennerflamme gepustet werden. Gehe jeweils so vor:
Für jedes Metall sollte ein eigener Strohhalm vorhanden sein! Bitte geht sparsam mit dem Material um. Das Metallpulver ist nicht so sehr billig! Pro Metall sollten zwei Versuche mit kleinen Mengen reichen! Aufräumen: Kehrt den Bereich des Experimentes, damit kein Metallpulver mehr herumliegt. Schaltet den Bunsenbrenner ganz aus, wenn keine Gruppe direkt nach euch dran ist. |
| VERSUCH: (3) Vergleich der Reaktion verschiedener Metalle mit Schwefel
Schau dir die folgenden Experimente an, bei denen Schwefel mit verschiedenen Metallen reagiert. Du findest auf den verlinkten Seiten jeweils den Film sowie noch einmal Bilder aus dem Film, wo die wichtigsten Momente noch einmal festgehalten sind. Es lohnt sich meist die Filme größere anzuschauen und auch die Bilder darunter noch einmal zu betrachten und die Erklärungen durchzulesen. |
| VERSUCH: (4) Kettenreaktion
Betrachte dir dieses Video, in dem man eine Kettenreaktion beobachten kann. 15px
Überlege dir dazu folgendes und notiere es:
|
VERSUCH:
Verwende bei beiden Versuchen eine Schutzbrille! Nimm eines der frischen Würfelzuckerstückchen. Versuch 1: Nutze den kleinen Gasbrenner und versuche den Zucker auf der unbrennbaren Unterfläche zu entzünden, indem du ihn stark erhitzt. Versuch 2: Gib nun etwas von der Asche auf das Zuckerstücken und versuche erneut den Zucker entzünden. Es sollte kein Haufen Asche sein, sondern dünn über die Zuckeroberfläche verteilt werden. Ein ähnliches Experiment kannst du dir 15px hier ansehen. Das solltest du auch tun, da man hier noch besser die Wirkung der Asche beobachten kann. |
Brandbekämpfung - praktisch und theoretisch
Ein Feuer kann nur brennen, wenn alle drei Bedingungen erfüllt sind:
Umgekehrt kann ein Feuer gelöscht werden, wenn eines der drei Bedingungen nicht erfüllt ist.
30px Aufgabe 6
Sucht nach praktischen Möglichkeiten, wie man ein Feuer löschen kann. Ordnet dann das Löschverfahren einer Seite des Dreiecks zu, um zu erklären, warum das Löschmittel wirken kann. |
Warum reagieren Stoffe miteinander?
Erst einmal zu den Ionen - Was steckt da dahinter?
| Edelgasregel: Die meisten Ionen der Hauptgruppen nehmen Elektronen auf oder geben sie ab, um die gleiche Elektronenkonfiguration wie benachbarte Edelgase zu erreichen.
Offensichtlich stellt diese Anzahl einen stabilen Zustand dar, denn Edelgase sind sehr reaktionsträge und bilden fast keine Verbindungen. |
Reaktion von Natrium mit Chlor - wo ist da Energie im Spiel
30px Aufgabe 7
Das Video zeigt, wie die Reaktion von Natrium mit Chlor zu Natriumchlorid abläuft. Schau dir das Video zwei Mal an und halte fest an welchen Stellen eine Energiezufuhr stattfindet und wo Energie freigesetzt wird? Finde Beschreibungen für die einzelnen Schritte, und ob und wie Energie zugeführt oder frei wird. → Hier noch ein weiteres Video, wo das Experiment etwas anders durchgeführt wird. |
30px Aufgabe 8
Die Reaktion von Natrium mit Chlor wird in den zwei Animationen auch auf atomarer Ebene betrachtet. Betrachte auch hier wieder, wie bei der vorherigen Aufgabe, welche Schritte hier stattfinden mit dem Energieumsatz und ergänze eventuell fehlende Schritte in deinen vorherigen Notizen. |
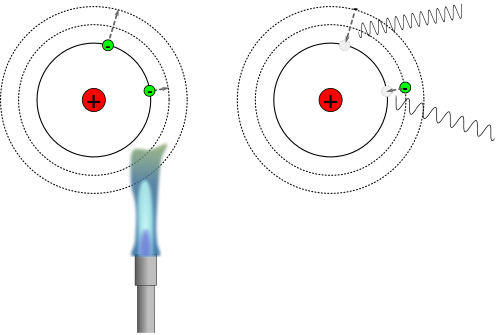
Ionisierungsenergie
Ein Aspekt, der bei der Einzelbetrachten Schritte zur Kochsalz-Synthese war die Tatsache, dass das Entfernen eines Elektrons aus einem Atom Energie "kostet". Und das erscheint logisch, denn der Kern mit den positiv geladenen Protonen zieht die Elektronen in der Atomhülle an. Generell nennt man die benötigte Energie Ionisierungsenergie. Die Defintion lautet genau:
| Ionisierungsenergie nennt man die Energie, die man benötigt um eine Elektron aus dem Atom zu entfernen. |
Was sicher auch logisch ist, ist dass die Ionisierungsenergie nicht immer identisch ist, denn wir haben ja ganz unterschiedliche Atome mit unterschiedlich vielen Protonen und Elektronen. Das folgende Diagramm zeigt die Ionisierungsenergie in Abhängigkeit der Kernladungszahl bzw. dem Element.
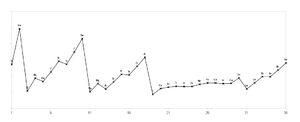
Nun sollst du schauen, ob du erklären und verstehen kannst, wie die Ionisierungsenergie der verschiedenen Elemente erklärt werden kann.
Die folgende verlinkten Darstellungen ermöglichen es dir, den Vorgang der Ionisierung, also das Entfernen eines Elektrons, zu visualisieren und nachzuvollziehen. Wir konzentrieren uns auf die ersten Alkalimetalle in der ersten Hauptgruppe, also Lithium Li, Natrium Na und Kalium K.
30px Aufgabe 9
<popup_name=Lösung>Je mehr positive und negative Ladungen die Atome haben, desto stärker sollte die Anziehung sein. Daher müsste die Anziehung, also auch die Ionisierungsenergie, von Lithium über das Natrium bis hin zum Kalium zunehmen. Den genauen Wert kann man hier nur raten, aber es sollte in etwa abnehmen, ob proportional oder nicht ist hier egal. Tatsächlich ist es aber anders herum! Die Ionisierungsenergie ist beim Lithium an größten und nimmt dann in der Hauptgruppe immer weiter ab. Kalium hat von den drei Alkalimetallen die nidrigste Ionisierungsenergie. Das ist ein Widerspruch zu unser Überlegung zu der Anziehung von Elektronen und Protonen. Ein Fazit muss sein, dass das bisherige Atommodell entweder einen Fehler hat oder nicht vollständig ist und verbessert werden muss. </popup> |
| Das Schalenmodell ist ein Atommodell, bei dem sich die Elektronen in der Hülle auf konzentrischen Schalen verteilen, ähnlich etwa wie die Schalen einer Zwiebel. Jede Schale ist der räumliche Aufenthaltsbereich von Elektronen mit ähnlichen Bindungsenergien. Die innerste, dem Atomkern nächstgelegene Schale wird K-Schale genannt. Sie enthält maximal zwei Elektronen. Auf der nächsten Schale, der L-Schale finden maximal acht Elektronen Platz. Je weiter die Schalen vom Kern entfernt sind, desto mehr Platz ist für Elektronen vorhanden. Auf die n-te Schale passen 2n² Elektronen. |
Und wie passt das nun mit der Ionisierungsenergie zusammen?
30px Aufgabe 10
Betrachte die schon bekannte Darstellung zur Visualisierung der Ionisierungsenergie, nun aber mit dem Schalenmodell Überlege dir folgendes und halte es fest:
|
| MERKE: Bei allen Elementen der Hauptgruppe gilt, dass die Anzahl der Elektronen auf der äußersten Schale der Nr. der Hauptgruppe entspricht! |
Schalenmodell
Spektren bei Flammenfärbungen weisen auf das Schalenmodell hin
Die Natriumchloridsynthese im Schalenmodell
Atombindungen
Warum sie zusammenhalten?
Kugelwolkenmodell für die Erklärung von Mehrfachbindungen
Aufgrund der Ionisierungenergie haben wir uns überlegt, dass die Elektronenhülle in unterschiedliche Schalen aufgeteilt sein soltle. Nur so lies sich erklären, dass die Ionisierungenergie bei den Alkalimetallen immer wieder so klein wurde. Nämlich genau dann, wenn eine neue Schale hinzukam, wodurch aufgrund der größeren Entfernung zum Kern die Anziehung auf das äußerste Elektron wesentlich kleine wurde.
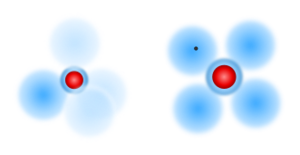
Schaut man noch ein wenig genauer hin, so fallen "Zacken" auf, die innerhalb einer Periode bei der Ionisierungsenergie auftauchen. Dies und auch die Frage, wie es denn räumlich möglich ist, dass zwei Atome sich vier oder gar 6 Elektronen teilen können, um den Edelgaszustand zu erreichen. Wir müssen daher das Schalenmodell noch ein wenig verfeinern hin zum sogenannten Kugel-Wolken-Modell:
| Die Kugelwolke oder auch Elektronenwolke ist als „Aufenthaltsraum“ für die Elektronen zu verstehen, in dem sie sich bewegen. Diese Wolke ist mathematisch als Bereich zu sehen, in dem Wahrscheinlichkeit am größten ist, dass sich ein bestimmtes Elektronen dort aufhält. |
Je weiter eine Elektronenschale vom Mittelpunkt des Atoms entfernt ist, desto mehr Elektronenwolken können geometrisch um den Kern angeordnet werden. Dementsprechend passen bei wachsender Entfernung immer mehr Elektronenwolken auf eine Schale.
- Erste Schale (K-Schale) = 2 Elektronen = 1 Elektronenwolke
- Zweite Schale (L-Schale) = 8 Elektronen = 4 Elektronenwolken
- Dritte Schale (M-Schale) = 18 Elektronen = 9 Elektronenwolken
- Vierte Schale (N-Schale) = 32 Elektronen = 16 Elektronenwolken
Da aufgrund der Verteilung der Elektronen auf die Schalen im Schalenmodell aber maximal 8 Elektronen auf der äußersten Schale vorkommen, sind bei einzelnen Atomen immer maximal 4 Elektronenwolken vorhanden.
Regeln zum Auffüllen der Elektronen im Kugelwolkenmodell:
|
Bei der Darstellung des Kugelwolken-Modell gibt es zwei Möglichkeiten:
- Man zeichnet die vier Kugelwolken räumlich in einer tetraedrischen Anordnung. Das entspricht genau der richtigen Position, ist aber etwas unübersichtlich. Im Bild wird daher über die unterschiedliche Anzahl an Elektronen durch verschiedene Färbung der Kugelwolken angedeutet!
- Man zeichnet die vier Kugelwolken flach um den Kern herum angeordnet. Die Darstellung ist nicht ganz genau, aber leichter zu zeichnen. Man kann die Anordnung der Elektronen aber gut und übersichtlich darstellen.
Beide Varianten haben ihren Vorteil. Das 3D-Modell wird eigentlich vor allem benötigt, um die räumliche richtige Anordnung bei Bindungen zu erkennen, oder wenn man eine Dreifach-Bindung hat, wie es beim Stickstoff der Fall ist. Hier nun ein Vergleich von verschiedenen Verbindungen, wie sie in den zwei Darstellungs-Varianten aussehen.
Kugelwolkenmodell und Lewisschreibweise
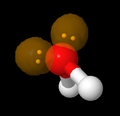
Letzendlich ist die Darstellung im Kugelwolken-Modell aber auch nur ein Hilfsmittel zu Verständnis, wie eine Mehrfach-Atombindung möglich ist. Als Vereinfachung nutzen wir daher zukünftig immer die schon vorgestellte Lewisschreibweise, bei der wir für ein Elektronenpaar einen Strich und für ein einzelnes Elektron einen Punkt zeichnen. Dies ist die einfachste Schreibweise, die schnell gezeichnet ist und einem hilft, die Anordnung der Elektronen schnell darzustellen. Beim Unsicherheit, kann man sich wieder an dem Kugelwolken-Modell orientieren, um zum Beispiel sich auch klar zu machen, wie die genaue Position der Kugelwolken untereinander und damit die Position der verbunden Atome zueinander ist.
- WasserValenz.svg
Aufgrund der tetraedrischen Anordnung, hat man bei Wasser H2O zwischen den Wasserstoff-Atomen einen Winkel von etwa 109° statt einem rechten Winkel.
- Methan Lewis.svg
Eigentlich gibt es auch beim Methan CH4 einen Winkel von etwa 109° zwischen den Wasserstoffatomen am zentralen Kohlenstoff-Atom. Die Lewisschreibweise vereinfacht das, indem alle Winkel gleich gezeichnet werden.
- Essigsäure Valenzstrichformel.svg
Bei der Essigsäure CH3COOH ist die Anordnung im rechten Bereich recht genau, beim linken Kohlenstoff-Atom haben wir die gleiche Vereinfachung, wie beim Methan.
Die ersten drei Perioden sehen im "flachen" Kugelwolken-Modell und in der Lewis-Schreibweise dann so aus:
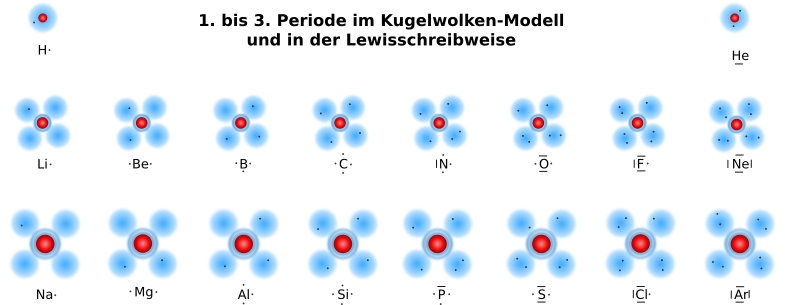
Um dir das "Aufstellen" einer Strukturformel in der Lewisschreibweise zu erleichtern, gibt es einen Molekülbaukasten, mit du nun etwas arbeiten und dir einige Moleküle aufgrund der Summenformel zusammenbauen kannst. Aufgrund des gebauten Moleküls ergibt sich direkt die Lewisschreibweise und auch der geometrische Aufbau des Moleküls.
Die Atome haben eine genau festgelegte Anzahl an Anschlüssen, die sich aus der Verteilung der Elektronen im Kugelwolkenmodell ergibt. Hier einige Atome, die im Baukasten bei uns vorkommen:
- Molekül-Baukasten-Kohlenstoff-Atom.png
Kohlenstoff-Atom im Baukasten ...
- Molekül-Baukasten-Sauerstoff-Atom.png
Sauerstoff-Atom im Baukasten ...
- Molekül-Baukasten-Stickstoff-Atom.png
Stickstoff-Atom im Baukasten ...
- Molekül-Baukasten-Chlor-Atom.png
Chlor-Atom im Baukasten ...
Was aber tun, wenn du kein passendes "Atom" im Kasten hast, wie zum Beispiel bei Brom oder Phosphor?
Fehlen Atome, so können sie ersetzt werden durch Atome der gleichen Hauptgruppe, da bei diesen die Elektronenverteilung die gleiche ist. (siehe Periodendensystem mit Kugelwolkenmodell und Lewisschreibweise!)
|
Wenn alle "Anschlüsse" besetzt sind, hat jedes Molekül seinen Edelgaszustand erreicht. Hier zwei Beispiele, für Verbindungen aus Kohlenstoff und Wasserstoff, jeweils mit der Summenformel und der Lewisschreibweise dazu.
- Molekül-Baukasten Methan.png
Methan, mit der Summeformel CH4 in Modell ...
- Methane-2D-square.png
... und Methan in der Lewisschreibweise.
- Molekül-Baukasten Ethan.png
Ethan, mit der Summenformel C2H6 in Modell ...
- Ethan Lewis.svg
... und Ethan in der Lewisschreibweise.
Fehler, die beim Zeichnen der Lewisschreibweise öfters auftreten, sollten zur Sicherheit immer kontrolliert werden:
|
30px Aufgabe 1
Du sollst gleich mit dem Modellbaukasten Moleküle basteln. Überlege dir folgendes vorher noch einmal, damit du vom Modell richtig auf die Lewisschreibweise folgern kannst:
|
30px Aufgabe 2
Nutze den Modellbaukasten, um die folgenden Moleküle zu bauen.
ACHTE DARAUF: Es dürfen keine Anschlüsse übrig bleiben! Halte die gebauten Moleküle als Bild fest, stellt die Bindungswinkel fest und versuche daraus eine möglichst genaue Lewis-Schreibweise zu notieren unter Beachtung der Bindungswinkel. |
30px Aufgabe 3 (HAUSAUFGABE)
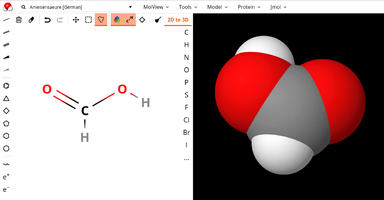
Nutze das Online-Programm molview.org um dir 3D-Moleküle anzeigen zu lassen. Du kannst links oben die Namen der gesuchten Verbindungen eingeben. Größtenteils kennt das Programm auch den deutschen Namen. Falls du in der Schule mit der Aufgabe 2 fertig geworden bist, bearbeite die fehlenden Verbindungen. Lass dir zusätzlich die folgenden Verbindungen anzeigen:
ACHTE DARAUF: Du bekommst hier nicht die freien Elektronenpaare angezeigt. Ergänze sie, bis genügend Elektronen vorhanden sind. Dazu kannst du dir auch einfach überlegen, wieviele freie Elektronenpaare das Einzel-Atom hat.
|
Warum wird bei Reaktionen mit Atombindungen Energie frei?
Bei Ionenverbindungen hatten wir ja schon genauer nachgeschaut, wo die Energie herkommt, die die Bildung einer Ionenverbindung zu einer exothermen Reaktion macht. Das wollen wir uns nun auch genauer anschauen bei Reaktionen, in denen Moleküle als Edukte genutzt werden oder bei einer Reaktion entstehen.
| Bei Reaktionen findet nach der Atom-Theorie von Dalton nur eine Umlagerung von Atomen statt. |
Diese "alte" Regel gilt immer noch, auch wenn wir vom Wissen her nun weiter sind als Dalton und schon begründen können, warum Atome in Verbindungen zusammenhalten. Trotzdem findet bei Reaktionen eine Umlagerung der Atom statt. Ein einfaches Beispiel:
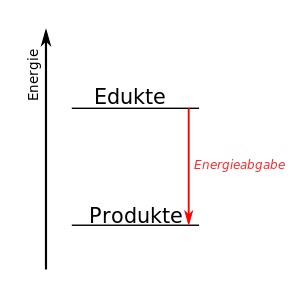
Diese Reaktion beschreibt die Verbrennung von Methan zu Kohlendioxid und Wasser. Die Reaktion ist exotherm, denn die Verbrennung von Methan (also quasi Ergdas) wird ja zum Heizen verwendet, es wird also chemische Energie in Wärme-Energie umgewandelt.
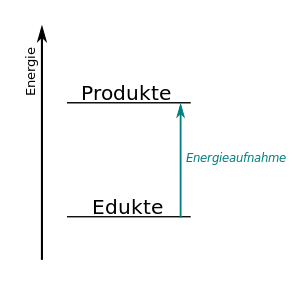
Nun muss man bei der Reaktion bedenken, dass die Entstehung z.B. von Kohlendioxid eine Zwischenstufe benötigt, die hier nicht dargestellt ist. Damit Kohlendioxid entstehen kann, muss das Methan-Molekül zerlegt werden, dass heißt, dass die Wasserstoffatome vom Kohlenstoff getrennt werden müssen. Und auch die Sauerstoff-Moleküle O2 müssen zerlegt werden. Beide Änderungen benötigen Energie, denn wir haben ja festgehalten, dass die Atombindung stabil ist, das also die Atome sich dank eines gemeinsamen Elektronenpaars anziehen. Und diese Anziehung müssen wir für die Trennung überwinden, das heißt, dass es zunächst einmal ein endothermener Vorgang ist.
Wieviel Energie das Aufbrechen einer Bindung benötigt, hat man inzwischen bei vielen Verbindungen und Bindungsarten durch Messungen herausgefunden. Dazu hat man einzelne Stoffe untersucht und probiert, bei welcher Energiezufuhr (Erwärumung) die Bindungen nicht mehr halten und der Stoff in einzelne Atome zerfällt.
30px Aufgabe XX
Warum sind Bindungen unterschiedlich stark. Versuche verschiedenen Gründe zu finden, warum sich verschiedene Atome unterschiedlich stark anziehen? |
Hier ein kleine Tabelle mit verschiedenen Bindungen und ihren Bindungsenergieen:
| Bindungsart | Bindungsenergie |
| C-H | 413 |
| O-H | 463 |
| C−C | 348 |
| C=C | 614 |
| C≡C | 839 |
| C−O | 358 |
| C=O | 745 |
| H−H | 436 |
| N≡N | 945 |
| O−O | 146 |
| O=O | 498 |
|
Ausgleichen von Reaktionsgleichungen
Das Ausgleichen von Reaktionsgleichungen ist eine typische Übung, die in Chemie immer wieder vorkommt. Wie du schon bei den Überlegungen zur Verbrennungsenergie kennengelernt hast, ist das zum Beispiel wichtig, damit man die genaue Anzahl an Bindungen in den Molekülen kennt. Später wird es noch wichtig für Mengen-Berechnungen sein, um z.B. vorher ausrechnen zu können, wieviel man von welchem Ausgangsstoffe braucht, um eine bestimmte Menge eines Produktes zu bekommen.
Auf der folgenden Unterseite bekommst du eine ausführliche Einführung mit vielen Vorübungen, damit du zum Profi im Ausgleichen von Reaktionsgleichungen wirst.
Wichtig für die Reaktionsgleichungen ist das Verständnis für die Symbolschreibweise. Wenn du da nicht sicher bist, solltest du auf dieser Seite noch einmal alles durchgehen.