Chemische Stoffe: Unterschied zwischen den Versionen
(+ 10 categories using HotCat) |
|||
| (51 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 7: | Zeile 7: | ||
|} | |} | ||
</center> | </center> | ||
| + | |||
{{Kurzregel|Stoffe sind die Materialien, aus denen unsere Welt zusammengesetzt ist. Jeder Stoff hat eine bestimmte, für ihn typische Kombination an Eigenschaften. | {{Kurzregel|Stoffe sind die Materialien, aus denen unsere Welt zusammengesetzt ist. Jeder Stoff hat eine bestimmte, für ihn typische Kombination an Eigenschaften. | ||
| − | * Verschiedene Stoffe unterscheiden sich in ihren Eigenschaften. | + | * '''Verschiedene Stoffe''' unterscheiden sich in ihren Eigenschaften. |
| − | * Stoffe unterscheidet man nicht anhand von ihren Zuständen. So kann der Stoff Wasser als Flüssigkeit aber auch als gasförmiger Wasserdampf oder festes Eis vorkommen. | + | * Stoffe unterscheidet man nicht anhand von ihren Zuständen. So kann der Stoff '''Wasser''' als '''Flüssigkeit''' aber auch als '''gasförmiger Wasserdampf''' oder '''festes Eis''' vorkommen. |
| − | * Keine Eigenschaften sind dagegen solche "Fähigkeiten" die sich aus der Bauform ergeben. So sind ein Nagel (spitz) oder eine Feder (elastisch) keine Stoffe. | + | * Keine Eigenschaften sind dagegen solche "Fähigkeiten" die sich aus der Bauform ergeben. So sind ein Nagel (spitz) oder eine Feder (elastisch) keine Stoffe. Sie bestehen aus dem Stoff Eisen. |
}} | }} | ||
| + | |||
| + | == Stoffeigenschaften == | ||
| + | Wenn ich die Stoffeigenschaften aufzählen würde, könnte ich einfach den Wikipedia-Artikel {{wpde|Stoffeigenschaft|Stoffeigenschaft}} kopieren. Das ist aber sicher nicht notwendig! | ||
| + | |||
| + | Wenn ihr euch die Liste anschaut, könnt ihr auch gleich bei unbekannten Begriffen nachschauen, was man darunter versteht. Meist sollte es reichen, wenn ihr die ersten Zeilen Seite durchlest, um zu verstehen, um was es geht. Falls das nicht reicht, fagt lieber jemand Kundigen ... ''nicht dass ihr euch in Wikipedia verlauft, denn man ist versucht, sich immer weiter in die Tiefe zu klicken, was meist nichts hilft''. | ||
| + | |||
| + | Im Artikel steht auch, für das die Eigenschaften wichtig sind. Das werden wir uns teilweise auch genauer anschauen und dazu Experimente machen und noch mehr erfahren. | ||
| + | |||
| + | * In der '''Analytik''' werden Stoffe in einer unbekannten Probe anhand ihrer Stoffeigenschaften '''identifiziert''' und '''klassifiziert'''. | ||
| + | * Die jeweiligen Stoffeigenschaften machen einen Stoff technisch als '''Werkstoff''' nutzbar. Teilweise stellen Chemiker deshalb gezielt Stoffe her, die die gewünschten Eigenschaften haben. | ||
| + | * Unter Nutzung der Stoffeigenschaften lassen sich '''Stoffgemische in ihre Einzelkomponenten auftrennen'''. Das ist aus verschiedenen Gründen wichtig - ein wichtiger Grund ist sicher die Gewinnung von reinen Rohstoffen für z.B. die Industrie. Zum einen gibt es in der Natur kaum reine Stoffe, denn sie sind meist verunreinigt und dann hat man mit dem Recycling von Abfall eine immer wichtigere Quelle für Rohstoffe. | ||
| + | * Um ein im Arzneimittel- oder Chemielabor neu hergestelltes Präparat, einen chemischen Stoff näher zu charakterisieren und seine '''Reinheit''' und Qualität zu kontrollieren, untersucht man dessen Eigenschaften. | ||
| + | |||
| + | === Identifiziere die 5 weißen Stoffe === | ||
| + | {{Versuche|1=Gegegen sind 5 weiße, pulvrige Feststoffe. Untersuche sie, damit du sie den bekannten Stoffen (Gips, Zucker, Salz, Natron, Zitronensäure) zuordnen kannst. Folgende Untersuchungen sollten durchgeführt werden: | ||
| + | * Löslichkeit in Wasser (den Stoff portionsweise in eine bestimmte Menge an Wasser geben und schauen, wie viel sich drin löst) | ||
| + | ** Stromleitfähigkeit der Lösung | ||
| + | ** Auswirkung der Lösung auf Rotkohlsaft (''bleibt grün = neutral, wird rot = saure Lösung, wird grün = seifige Lösung'') | ||
| + | * Wirkung von Essig auf die Stoffe selber | ||
| + | * Aussehen der Partikel der Stoffe (regelmäßige kristalline Formen?) | ||
| + | * Verhalten der Stoffe beim Erhitzen | ||
| + | |||
| + | <u>Hinweise zur Durchführung der Experimente gibt es im Buch:</u> | ||
| + | {{Buch|Untersuchung von Stoffen|Seite 23}} | ||
| + | |||
| + | Praktisch machen wir das so, dass eine Gruppe die bekannten Stoffe untersucht und deren Eigenschaften feststellt. Dann geben die anderen Gruppen die festgestellten Eigenschaften der unbekannten Stoffe 1 bis 5 bekannt und dann lassen sich diese unbekannten Stoffe hoffentlich richtig zuordnen. | ||
| + | }} | ||
| + | |||
| + | === Die Stoffgruppe der Metalle - ein wichtige Stoffgruppe === | ||
| + | Es gibt einige Stoffe, die man aufgrund ihrer sehr ähnlichen Eigenschaften in Stoffgruppen zusammenfasst. Merke dir die folgende <u>grobe</u> Einteilung: | ||
| + | {{Kurzregel| | ||
| + | * Die '''Metalle''' leiten elektrischen Strom und Wärme gut, sind gut verformbar und haben im reinen Zustand Oberflächenglanz. | ||
| + | * '''Nichtmetalle''' leiten den elektrischen Strom kaum (Isolatoren), sind im festen Zustand zumeist spröde und weisen niedrige Siedepunkte auf ''(Ausnahme: Diamant und Kunststoffe)'' | ||
| + | * '''Salzartige Stoffe''' haben relativ hohe Schmelz- und Siedetemperaturen, leiten als Schmelzen oder Lösungen den elektrischen Strom, sind kristallin und spröde. | ||
| + | }} | ||
| + | |||
| + | {{Buch|Stoffgruppen und ihre Eigenschaften|den Seiten 32 und 33}} | ||
| + | |||
| + | Die '''Stoffgruppe der Metalle''' ist die größte Gruppe bei den chemischen Grundstoffen, den Elementen. 80% der bekannte Elemente sind Metalle. Auch historisch hatten Metalle eine wichtige Bedeutung. Metalle waren nach der Verwendung von Holz und Stein die wichtigsten Werkstoffe, die auch die Entwicklung der Menschheit weit vorangebracht haben. Deshalb gibt es ja auch nach der '''Steinzeit''' die Zeitalter '''Bronzezeit''' und '''Eisenzeit'''. Gold war schon davor bekannt, denn es kommt als reines Metall in der Natur vor und ist aufgrund von seinen Eigenschaften leicht zu bearbeiten. Hier eine kleine Übersicht von wichtigen Metalle, die dir vermutlich schon vom Namen her bekannt sind, und für was wir sie brauchen. Eine ausführliche Übersicht, für was die verschiedenen Metalle gebraucht werden, findest du auf der Wikipedia-Seite zu {{wpde|Metalle#Verwendung|Metallen}}. | ||
| + | |||
| + | <gallery widths="180" heights="200" perrow="5" caption="Einige wichtige Metalle"> | ||
| + | File:GoldNugget.jpg|Ein '''Gold'''nugget. So etwas findet man nur mit viel Glück. Gold ist beliebt, da man es sehr gut bearbeiten kann und seinen schönen, goldenen Glanz immer behält. | ||
| + | Datei:Copper Roof Dresden 20070114.JPG|'''Kupfer''' (bzw. Bronze) war das erste Metall, dass die Menschheit herstellen konnte. Es ist auch gut verarbeitbar und trotzdem resistent gegen Umwelteinflüsse. Wichtiger ist aber heute für uns seine gute Stromleitfähigkeit. | ||
| + | Datei:Eisen 1.jpg|Hochreines Ein Stück hochreines '''Eisen''' (99,7 %) - sieht zwar ganz schön aus, aber so wird es nicht verwendet, da es viel zu spröde ist. | ||
| + | File:Silver crystal.jpg|Hier ein künstlich hergestelltes Kristall aus '''Silber'''. Es wird als Schmuckmetall aber auch in der Elektronik-Industrie gebraucht, da es der beste Strom- und Wärmeleiter ist. | ||
| + | File:Metal cube lead.jpg|'''Blei''' ist ein weiches Schwermetall. Früher aber auch heute wurde es zum Beispiel zur Dachabdichtung verwendet, heute vor allem in den Starterbatterien von Autos. | ||
| + | Datei:Verchromte Felge.jpg|'''Chrom''' hat sein Einsatz als Flächen-Überzug seinen Eigenschaften zu verdanken. Es ist nämlich ein silberweißes, korrosions- und anlaufbeständiges hartes Metall. | ||
| + | Datei:Filament.jpg |'''Wolfram''' ist ein Metall das zum Beispiel für die Glühwendel von Glühbirnen verwendet wird. Wolfram ist dafür ideal, denn es hat eine sehr hohe Schmelztemperatur von über 3500°C. | ||
| + | File:Aluminium.jpg|Das '''Aluminium''' ist vor allem wegen seiner geringen Dichte als leichtes Konstruktionsmetall bekannt um z.B. den Treibstoffverbrauch in der Luft- und Raumfahrt zu verringern. Im Bild sieht man Alu-Folie. | ||
| + | Datei:Mercure natif 3(Espagne).jpg|'''Quecksilber''' ist das einzige Metall, dass bei Zimmertemperatur flüssig ist. Hier ein Tropfen auf dem Quecksilber-Mineral Cinnabarit. | ||
| + | Datei:Zinc fragment sublimed and 1cm3 cube.jpg|'''Zink''' ist ein wichtiges Metall, denn Überzüge davon schützen Eisen vor Korrosion und auch als Legierung (Gemisch) mit Kupfer kennt man es vom Messing. | ||
| + | </gallery> | ||
| + | |||
| + | |||
| + | {{Versuche|'''Lernzirkel Metalle''' | ||
| + | |||
| + | In XX Stationen wirst du die typischen Eigenschaften der Metalle genauer untersuchen können. Dabei geht es auch darum, welches Metall für welchen Einsatz geeignet ist. Folgende Stationen gibt es: | ||
| + | * ... | ||
| + | * ... | ||
| + | }} | ||
| + | |||
| + | ==Spezielle Eigenschaften == | ||
| + | |||
| + | === Dichte ... Mathe in der Chemie === | ||
| + | |||
| + | ''Kein Wunder das ich ich als anderes Fach neben Chemie noch Mathe habe ... die zwei Fächer passen perfekt zusammen! Genauer ist es so: die Mathematik ist eine wichtige Hilfswissenschaft für die Chemie. Auch im Chemiestudium kommt man nicht um eine Mathe-Vorlesung herum.'' | ||
| + | |||
| + | Da das für euch vielleicht etwas ungewohnt ist, werden beim Thema "Dichte" nun einige wichtige Dinge angesprochen, die ihr immer wieder brauchen werdet. | ||
| + | |||
| + | {{Buch|Dichte|den Seiten 24 und 25}} | ||
| + | |||
| + | |||
| + | {{Kurzregel|Die Dichte ist die Masse von 1 cm³ eines Stoffes mit der Einheit <math>\frac{g}{cm ^3}</math> ''(lies: Gramm pro Kubikzentimeter)''}} | ||
| + | |||
| + | '''Mit anderen Worten:''' Die Dichte gibt an, wieviel eine Stoffportion mit einem Volumen von einem Kubikzentimeter eines Stoffes wiegt. Hat Gold die Dichte von 19,302 <math>\frac{g}{cm ^3}</math>, dann wiegt ein Würfelchen mit einer Kantenlänge von 1 cm dann 19,302 g, denn ein Würfel mit einer Seitenlänge von 1 cm hat ein Volumen von 1 cm³. | ||
| + | |||
| + | Viele Tabellenwerte zur Dichte verschiedener Stoffe sind in folgenden Artikeln zu finden: | ||
| + | * [http://de.wikibooks.org/wiki/Tabellensammlung_Chemie/_Dichte_fester_Stoffe Dichte fester Stoffe] | ||
| + | * [http://de.wikibooks.org/wiki/Tabellensammlung_Chemie/_Dichte_fl%C3%BCssiger_Stoffe Dichte flüssiger Stoffe] | ||
| + | * [http://de.wikibooks.org/wiki/Tabellensammlung_Chemie/_Dichte_gasf%C3%B6rmiger_Stoffe Dichte gasförmiger Stoffe] | ||
| + | |||
| + | ==== Berechnung der Dichte ==== | ||
| + | |||
| + | Für die Bestimmung der Dichtes eines Stoffes, den man nicht kennt, muss man also eine Stoffportion betrachten, deren Volumen und das Gewicht bestimmen. Die Dichte berechnet sich dann mit der Formel: | ||
| + | |||
| + | {{Kurzregel|<math>Dichte = \frac{Masse}{Volumen}</math> oder mit Symbolen <math>\rho =\frac{m}{V}</math>. | ||
| + | |||
| + | Bei dem "komischen Buchstaben handelt es sich um einen griechischen Buchstaben, wie ihr sie auch von der Winkelbenennung kennt. Hier ist es das kleine "rho" ''(lies: roh)''.}} | ||
| + | |||
| + | |||
| + | {{Kurzregel|Die Begriffe {{wpde|Leichtmetall|Leichtmetall}} und {{wpde|Schwermetall|Schwermetall}} haben mit der Dichte zu tun. Metalle mit einer Dichte von unter 5 <math>\frac{g}{cm ^3}</math> nennt man '''Leichtmetalle'''. Darüber sind es '''Schwermetalle'''.}} | ||
| + | |||
| + | |||
| + | ==== Berechnungen mit der Dichte ==== | ||
| + | Informationen und Aufgaben zu [[Frau_Lachner/Chemische_Stoffe/Berechnungen mit der Dichte|Berechnungen mit der Dichte]] gibt es auf einer Unterseite. | ||
| + | |||
| + | |||
| + | ==== Bedeutung der Dichte für den Auftrieb ==== | ||
| + | |||
| + | {|border=0 | ||
| + | |- | ||
| + | | | ||
| + | |||
| + | Das Bild rechts zeigt verschiedene <u>flüssige</u> und <u>feste</u> Stoffe übereinander. Von oben nach unten sind es: | ||
| + | |||
| + | * Baby-Öl | ||
| + | * rot angefärbter Reingungsalkohol (Isopropanol) | ||
| + | * Speise-Öl | ||
| + | * Wachs | ||
| + | * blau gefärbtes Wasser | ||
| + | * Aluminium | ||
| + | |||
| + | |||
| + | ''Klicke das Bild an, um es größer zu sehen!'' | ||
| + | |||
| + | |||
| + | {{AufgabeNr|1|Schlage die Dichten der Stoffe nach und stelle eine Vermutung an, was die Dichte mit der Beobachtung zu tun hat.}} | ||
| + | |||
| + | || [[File:Density_column.JPG|100px]] | ||
| + | |} | ||
| + | |||
| + | {{Kurzregel|Flüssige Stoffe ordnen sich in einem Gefäß immer so an, dass '''der Stoff mit der geringsten Dichte am weitesten oben''' ist. | ||
| + | |||
| + | Feste Stoffe können in einer Flüssigkeit ... | ||
| + | * '''an der Oberfläche schwimmen''' ... wenn die Dichte vom Feststoff geringer als die Dichte der Flüssigkeit ist. | ||
| + | * '''in der Flüssigkeit schweben''' ... wenn die Dichte vom Feststoff gleich der Dichte der Flüssigkeit ist. | ||
| + | * '''auf den Boden sinken''' ... wenn die Dichte vom Feststoff größer als die Dichte der Flüssigkeit ist. | ||
| + | |||
| + | ''Dies gilt natürlich nur, wenn die Stoffe sich nicht vermischen oder ineinander löslich sind.'' | ||
| + | }} | ||
| + | |||
| + | |||
| + | {{Versuche|'''Erhitzen von festem Wachs und Wasser''' | ||
| + | |||
| + | 1.) <u>Wachs:</u> Erhitze Wachs in einem Gefäß, so dass es schmilzt. Du kannst dazu zum Beispiel eine Teelicht auf die Herdplatte stellen und auf kleinster Stufe erhitzen. '''Erhitze nicht so stark, dass es raucht - dieser Wachsdampf könnte sich selbst entzünden!''' Bevor alles geschmolzen ist, sollte noch ein kleines Stück Wachs übrig sein. Wie "liegt" es im flüssigen Wachs? ''Liegt es auf dem Boden oder schwimmt es?'' | ||
| + | |||
| + | 2.) <u>Gefrorenes Wasser:</u> Erhitze auf gleiche Art und Weise Eis. Das Gefäß darf nicht zu flach sein! Wenn noch ein Stück festes Wasser im flüssigen Wasser übrigbleibt, wo ist dann das feste Wasser (also das Eis)? ''Liegt es auf dem Boden oder schwimmt es? | ||
| + | |||
| + | |||
| + | ''Falls du das Experiment zu Hause nicht durchführen kannst, hast du die Möglichkeit, es in einem {{Video}} [http://netexperimente.de/chemie/71.html Video] anzuschauen. Das Video kann aber auch jedem empfohlen werden, der es selber ausprobiert!''}} | ||
| + | |||
| + | |||
| + | |||
| + | {{AufgabeNr|2a|Bei dem Experiment, dass davor beschrieben wurde, geht es um die sogenannte '''Dichteanomalie des Wassers'''. Halte den Begriff im Heft fest und notiere, was an der Dichte von Wasser anders ist als bei den anderen Stoffen. ''Falls du das Experiment nicht durchgeführt hast kannst du dir auch den {{Video}} [http://netexperimente.de/chemie/71.html Video] anschauen.''}} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|2b|[[File:Anomalous expansion of water Summer Winter.svg|350px|left]] Was hat die Dichteanomalie hiermit zu tun? Und welche Bedeutung hat das für die Überlebensfähigkeit von Wasserbewohnern.}} | ||
| + | |||
| + | {{AufgabeNr|3|[[File:Dead_sea_newspaper.jpg|150px|left]] | ||
| + | |||
| + | Der Mann kann im Toten Meer bequem die Zeitung lesen, ohne unterzugehen. Wie du vielleicht weißt, ist das Wasser im Toten Meer sehr salzig. Wie wirkt sich das Salz offensichtlich aus?}} | ||
| + | |||
| + | ==== Abschluss ==== | ||
| + | |||
| + | {{AufgabeNr|4|Finde die typischen Fehler in den Aussage und korrigiere sie. ''Die richtige Lösung ist versteckt und kann zur Kontrolle nachgeschaut werden. | ||
| + | * Ein Stoff mit einer hohen Dichte wiegt viel. {{Lösung|Das Gewicht ist nicht nur von der Dichte abhängig sondern vor allem, wieviel man von dem Stoff hat. Auch ein Stoff mit einer hohen Dichte kann wenig wiegen, wenn ich nur eine ganz kleine Stoffportion davon habe. Umgekehrt genauso: die Dichte von Holz ist zwar recht niedrig, aber einem Baum kann man deshalb nicht tragen, wenn er aus zuviel Holz besteht. | ||
| + | * Holz schwimmt an der Oberfläche, weil es leichter ist. {{Lösung|Im Prinzip wieder das gleiche wie vorher: "leicht" bedeutet, das es um die Masse geht. Die Masse hängt aber von der Größe der Stoffportion ab, genau von dem Volumen der Stoffportion. Korrekt muss es heißen, das die Dichte von Holz geringer ist als die von Wasser.}}}} | ||
| + | ''}} | ||
| + | |||
| + | === Schmelz- und Siedetemperaturen === | ||
| + | |||
| + | {{Buch|Aggregatzustände|der Seite 26}} | ||
| + | |||
| + | Die Schmelz- und Siedetemperaturen sind sehr typische Eigenschaften anhand denen man häufig schon Stoffe erkennen kann. Sie bestimmen auch, welche Aggregatzustand ein Stoff bei Normal- oder Raumtemperatur (''offiziell auf 25°C festgelegt'') hat. | ||
| + | |||
| + | Es gibt die drei '''Aggregatzustände''': '''Fest''', '''Flüssig''' und '''Gasförmig'''. Die Übergänge zwischen den Aggregatzustände haben spezielle Namen. Es gibt allgemeine Bezeichnungen (''linkes Bild'') und solche, die wir meist beim Wasser (''rechtes Bild'') verwenden. | ||
| + | |||
| + | |||
| + | <center> | ||
| + | {| | ||
| + | |- | ||
| + | | [[Datei:Aggregatzustände schematisch.png|400px]]|| [[Datei:Aggregatzustaende.png]] | ||
| + | |} | ||
| + | </center> | ||
| + | |||
| + | |||
| + | <u>Alle Übergänge können am Beispiel Wasser im Alltag beobachtet werden:</u> | ||
| + | ;Schmelzen: Schnee oder Eis fängt im Frühjahr an flüssig zu werden, sobald Temperaturen oberhalb der '''Schmelztemperatur''' herrschen. | ||
| + | ;Erstarren: Kühlt das Wasser in Seen unter den '''Gefrierpunkt''' ab, bilden sich Eiskristalle, die mit der Zeit immer größer werden, bis die Oberfläche mit einer Eisschicht überzogen ist. | ||
| + | ;Verdampfen: Wird Wasser im Kochtopf über seine '''Siedetemperatur''' erhitzt, so wird das Wasser gasförmig. Das „Blubbern“ im Kochtopf kommt zustande, weil das Wasser am heißen Topfboden zuerst die Siedetemperatur erreicht - Die aufsteigenden Blasen sind der Wasserdampf, der (wie die meisten gasförmigen Stoffe) unsichtbar ist. ''Verdunstung'', der Übergang von flüssig in gasförmig ohne Erreichen der Siedetemperatur, ist bei Schweiß auf der Haut gut zu beobachten. | ||
| + | ;Kondensieren: Der deutlich sichtbare Nebel oberhalb kochenden Wassers, der meist umgangssprachlich als "Dampf" bezeichnet wird, ist zu winzigen Wassertröpfchen kondensierter Wasserdampf. Tau und Wolken entstehen ebenfalls durch kondensierenden Wasserdampf. | ||
| + | ;Sublimation: gefrorenen Pfützen können im Winter, auch bei Temperaturen weit unterhalb des '''Gefrierpunktes''', durch Sublimation nach und nach "austrocknen", bis das Eis vollständig sublimiert und die Pfütze verschwunden ist. | ||
| + | ;Resublimation: Raureif oder Eisblumen, die sich im Winter bilden, entstehen durch den aus der Umgebungsluft resublimierenden Wasserdampf. | ||
| + | |||
| + | |||
| + | {{Kurzregel| | ||
| + | * '''Schmelztemperatur:''' Die Temperatur, ab der ein fester Stoff flüssig wird, oder umgekehrt, bei der ein flüssiger Stoff beim Abkühlen fest wird ''(auch Gefriertemperatur genannt)''. | ||
| + | * '''Siedetemperatur:''' Die Temperatur, ab der ein flüssiger Stoff gasförmig wird, oder umgekehrt, bei der ein gasförmiger Stoff beim Abkühlen kondensiert.}} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|5|Lerne die Begriffe für die Übergänge zwischen den Aggregatzuständen, wenn du sie noch nicht kennst. Dazu gehört auch die Bedeutung der Schmelz- und Siedetemperatur in diesem Zusammenhang. | ||
| + | |||
| + | '''''Tipp:''' Zeichne dir ein ähnliches Diagramm (wie das linke hier) ins Heft. '' | ||
| + | * ''Etwas hübscher sieht es aus, wenn du für die drei Aggregatzustände passende Bilder zeichnest. So verwende ich für das Gas immer einen Luftballon, für den flüssigen Stoff ein mit Wasser gefülltes Glas und als Feststoff einen Würfel.'' | ||
| + | * ''Halte alle Begriffe fest, zeichne aber noch die '''Pfeile''' entweder '''rot''' oder '''blau''' ein, je nachdem ob man den Stoff erhitzen oder abkühlen muss, damit dieser Übergang stattfindet. Die Informationen zu den Übergängen helfen dir, dass zu erkennen!'' | ||
| + | * ''Die Begriffe speziell für die Übergänge beim Wasser kannst du in Klammern ergänzen.''}} | ||
| + | |||
| + | {{AufgabeNr|6|[[Datei:ARBEITSBLATT_Übergaenge_zwischen_den_Aggregatzuständen.pdf|right]]Bearbeite das [http://wikis.zum.de/chemie-digital/Datei:ARBEITSBLATT_%C3%9Cbergaenge_zwischen_den_Aggregatzust%C3%A4nden.pdf Arbeitsblatt]. Trage die Begriffe ein, wo man Übergänge zwischen den Aggregatzuständen hat. Färbe die Pfeile auch rot oder blau. }} | ||
| + | |||
| + | |||
| + | {{AufgabeNr|7|'''Welchen Aggregatzustand haben die folgenden Stoffen bei 200°C?''' Halte im Heft nach dem Stoffnamen die Schmelz- und Siedetemperatur fest und dann, wie der Aggregatzustand bei 200° ist: | ||
| + | * Brom, Gallium, Blei, Stickstoff, Eisen, Kohlenstoff, Schwefel, Kalium {{Lösung|1=<u>Zum Beispiel:</u> ''Wasser: Smt.=0°, Sdt.=100°C → Aggregatzustand bei 200° ist gasförmig'' {{Lösung|Brom → gasförmig, Gallium → flüssig, Blei → fest, Stickstoff → gasförmig, Eisen → fest, Kohlenstoff → fest, Schwefel → flüssig, Kalium → flüssig, }}}} | ||
| + | |||
| + | '''Welchen Aggregatzustand haben die folgenden Stoffen bei -150°C?''' | ||
| + | * Chlor, Iod, Quecksilber, Sauerstoff, Silber, Xenon {{Lösung|Chlor → fest, Iod → fest,Quecksilber → fest, Sauerstoff → gasförmig, Silber → fest, Xenon → fest}} | ||
| + | }} | ||
| + | |||
| + | |||
| + | {{Versuche|'''Bestimme Schmelz- und Siedetemperaturen von verschiedenen Stoffen''' | ||
| + | |||
| + | {{Buch|Praktikum: Schmelzen und Sieden näher betrachtet|Seite 28}} | ||
| + | |||
| + | Du kannst Schmelz- (bzw. Erstarrungstemperatur) und Siedetemperaturen bestimmen. Im Buch findest du Anleitungen, wie du vorgehen musst. Folgende Stoffe haben wir zur Verfügung: | ||
| + | * Ethanol | ||
| + | * Stearin | ||
| + | * ... | ||
| + | |||
| + | Beim Experimentieren musst du regelmäßig Zeitpunkt und Temperatur aufschreiben. Diese Werte können dann entweder von Hand oder mit einer Tabellenkalkulation als Liniendiagramm gezeichnet werden.}} | ||
| + | |||
| + | === Löslichkeit in Wasser und anderen Flüssigkeiten === | ||
| + | |||
| + | ... | ||
| + | |||
| + | [[Kategorie:Stoffe]] | ||
| + | [[Kategorie:Stoffeigenschaften]] | ||
| + | [[Kategorie:Dichte]] | ||
| + | [[Kategorie:Dichteanomalie]] | ||
| + | [[Kategorie:Aggregatzustände]] | ||
| + | [[Kategorie:Aufgaben]] | ||
| + | [[Kategorie:Versuche]] | ||
| + | [[Kategorie:Schüler-Aktivitäten]] | ||
| + | [[Kategorie:Stoffklasse]] | ||
| + | [[Kategorie:Metalle]] | ||
Aktuelle Version vom 13. Mai 2015, 20:26 Uhr
| Nicht nur das sind Stoffe in der Chemie ... | auch hier gibt es viele verschiedene Stoffe! |
| 400px | 480px |
Stoffe sind die Materialien, aus denen unsere Welt zusammengesetzt ist. Jeder Stoff hat eine bestimmte, für ihn typische Kombination an Eigenschaften.
|
Inhaltsverzeichnis |
Stoffeigenschaften
Wenn ich die Stoffeigenschaften aufzählen würde, könnte ich einfach den Wikipedia-Artikel 19px Stoffeigenschaft kopieren. Das ist aber sicher nicht notwendig!
Wenn ihr euch die Liste anschaut, könnt ihr auch gleich bei unbekannten Begriffen nachschauen, was man darunter versteht. Meist sollte es reichen, wenn ihr die ersten Zeilen Seite durchlest, um zu verstehen, um was es geht. Falls das nicht reicht, fagt lieber jemand Kundigen ... nicht dass ihr euch in Wikipedia verlauft, denn man ist versucht, sich immer weiter in die Tiefe zu klicken, was meist nichts hilft.
Im Artikel steht auch, für das die Eigenschaften wichtig sind. Das werden wir uns teilweise auch genauer anschauen und dazu Experimente machen und noch mehr erfahren.
- In der Analytik werden Stoffe in einer unbekannten Probe anhand ihrer Stoffeigenschaften identifiziert und klassifiziert.
- Die jeweiligen Stoffeigenschaften machen einen Stoff technisch als Werkstoff nutzbar. Teilweise stellen Chemiker deshalb gezielt Stoffe her, die die gewünschten Eigenschaften haben.
- Unter Nutzung der Stoffeigenschaften lassen sich Stoffgemische in ihre Einzelkomponenten auftrennen. Das ist aus verschiedenen Gründen wichtig - ein wichtiger Grund ist sicher die Gewinnung von reinen Rohstoffen für z.B. die Industrie. Zum einen gibt es in der Natur kaum reine Stoffe, denn sie sind meist verunreinigt und dann hat man mit dem Recycling von Abfall eine immer wichtigere Quelle für Rohstoffe.
- Um ein im Arzneimittel- oder Chemielabor neu hergestelltes Präparat, einen chemischen Stoff näher zu charakterisieren und seine Reinheit und Qualität zu kontrollieren, untersucht man dessen Eigenschaften.
Identifiziere die 5 weißen Stoffe
| VERSUCH:
Gegegen sind 5 weiße, pulvrige Feststoffe. Untersuche sie, damit du sie den bekannten Stoffen (Gips, Zucker, Salz, Natron, Zitronensäure) zuordnen kannst. Folgende Untersuchungen sollten durchgeführt werden:
Hinweise zur Durchführung der Experimente gibt es im Buch:
Praktisch machen wir das so, dass eine Gruppe die bekannten Stoffe untersucht und deren Eigenschaften feststellt. Dann geben die anderen Gruppen die festgestellten Eigenschaften der unbekannten Stoffe 1 bis 5 bekannt und dann lassen sich diese unbekannten Stoffe hoffentlich richtig zuordnen. |
Die Stoffgruppe der Metalle - ein wichtige Stoffgruppe
Es gibt einige Stoffe, die man aufgrund ihrer sehr ähnlichen Eigenschaften in Stoffgruppen zusammenfasst. Merke dir die folgende grobe Einteilung:
|
| 50px | Im Buch zu lesen: Zum Thema Stoffgruppen und ihre Eigenschaften findest du in unserem Buch Informationen auf den Seiten 32 und 33. |
Die Stoffgruppe der Metalle ist die größte Gruppe bei den chemischen Grundstoffen, den Elementen. 80% der bekannte Elemente sind Metalle. Auch historisch hatten Metalle eine wichtige Bedeutung. Metalle waren nach der Verwendung von Holz und Stein die wichtigsten Werkstoffe, die auch die Entwicklung der Menschheit weit vorangebracht haben. Deshalb gibt es ja auch nach der Steinzeit die Zeitalter Bronzezeit und Eisenzeit. Gold war schon davor bekannt, denn es kommt als reines Metall in der Natur vor und ist aufgrund von seinen Eigenschaften leicht zu bearbeiten. Hier eine kleine Übersicht von wichtigen Metalle, die dir vermutlich schon vom Namen her bekannt sind, und für was wir sie brauchen. Eine ausführliche Übersicht, für was die verschiedenen Metalle gebraucht werden, findest du auf der Wikipedia-Seite zu 19px Metallen .
- Einige wichtige Metalle
- GoldNugget.jpg
Ein Goldnugget. So etwas findet man nur mit viel Glück. Gold ist beliebt, da man es sehr gut bearbeiten kann und seinen schönen, goldenen Glanz immer behält.
- Copper Roof Dresden 20070114.JPG
Kupfer (bzw. Bronze) war das erste Metall, dass die Menschheit herstellen konnte. Es ist auch gut verarbeitbar und trotzdem resistent gegen Umwelteinflüsse. Wichtiger ist aber heute für uns seine gute Stromleitfähigkeit.
- Eisen 1.jpg
Hochreines Ein Stück hochreines Eisen (99,7 %) - sieht zwar ganz schön aus, aber so wird es nicht verwendet, da es viel zu spröde ist.
- Silver crystal.jpg
Hier ein künstlich hergestelltes Kristall aus Silber. Es wird als Schmuckmetall aber auch in der Elektronik-Industrie gebraucht, da es der beste Strom- und Wärmeleiter ist.
- Metal cube lead.jpg
Blei ist ein weiches Schwermetall. Früher aber auch heute wurde es zum Beispiel zur Dachabdichtung verwendet, heute vor allem in den Starterbatterien von Autos.
- Verchromte Felge.jpg
Chrom hat sein Einsatz als Flächen-Überzug seinen Eigenschaften zu verdanken. Es ist nämlich ein silberweißes, korrosions- und anlaufbeständiges hartes Metall.
- Filament.jpg
Wolfram ist ein Metall das zum Beispiel für die Glühwendel von Glühbirnen verwendet wird. Wolfram ist dafür ideal, denn es hat eine sehr hohe Schmelztemperatur von über 3500°C.
- Aluminium.jpg
Das Aluminium ist vor allem wegen seiner geringen Dichte als leichtes Konstruktionsmetall bekannt um z.B. den Treibstoffverbrauch in der Luft- und Raumfahrt zu verringern. Im Bild sieht man Alu-Folie.
- Mercure natif 3(Espagne).jpg
Quecksilber ist das einzige Metall, dass bei Zimmertemperatur flüssig ist. Hier ein Tropfen auf dem Quecksilber-Mineral Cinnabarit.
- Zinc fragment sublimed and 1cm3 cube.jpg
Zink ist ein wichtiges Metall, denn Überzüge davon schützen Eisen vor Korrosion und auch als Legierung (Gemisch) mit Kupfer kennt man es vom Messing.
| VERSUCH:
Lernzirkel Metalle In XX Stationen wirst du die typischen Eigenschaften der Metalle genauer untersuchen können. Dabei geht es auch darum, welches Metall für welchen Einsatz geeignet ist. Folgende Stationen gibt es:
|
Spezielle Eigenschaften
Dichte ... Mathe in der Chemie
Kein Wunder das ich ich als anderes Fach neben Chemie noch Mathe habe ... die zwei Fächer passen perfekt zusammen! Genauer ist es so: die Mathematik ist eine wichtige Hilfswissenschaft für die Chemie. Auch im Chemiestudium kommt man nicht um eine Mathe-Vorlesung herum.
Da das für euch vielleicht etwas ungewohnt ist, werden beim Thema "Dichte" nun einige wichtige Dinge angesprochen, die ihr immer wieder brauchen werdet.
| 50px | Im Buch zu lesen: Zum Thema Dichte findest du in unserem Buch Informationen auf den Seiten 24 und 25. |
Die Dichte ist die Masse von 1 cm³ eines Stoffes mit der Einheit 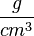 (lies: Gramm pro Kubikzentimeter) (lies: Gramm pro Kubikzentimeter)
|
Mit anderen Worten: Die Dichte gibt an, wieviel eine Stoffportion mit einem Volumen von einem Kubikzentimeter eines Stoffes wiegt. Hat Gold die Dichte von 19,302 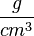 , dann wiegt ein Würfelchen mit einer Kantenlänge von 1 cm dann 19,302 g, denn ein Würfel mit einer Seitenlänge von 1 cm hat ein Volumen von 1 cm³.
, dann wiegt ein Würfelchen mit einer Kantenlänge von 1 cm dann 19,302 g, denn ein Würfel mit einer Seitenlänge von 1 cm hat ein Volumen von 1 cm³.
Viele Tabellenwerte zur Dichte verschiedener Stoffe sind in folgenden Artikeln zu finden:
Berechnung der Dichte
Für die Bestimmung der Dichtes eines Stoffes, den man nicht kennt, muss man also eine Stoffportion betrachten, deren Volumen und das Gewicht bestimmen. Die Dichte berechnet sich dann mit der Formel:
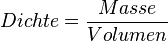 oder mit Symbolen oder mit Symbolen 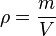 . .
Bei dem "komischen Buchstaben handelt es sich um einen griechischen Buchstaben, wie ihr sie auch von der Winkelbenennung kennt. Hier ist es das kleine "rho" (lies: roh). |
Die Begriffe 19px Leichtmetall und 19px Schwermetall haben mit der Dichte zu tun. Metalle mit einer Dichte von unter 5 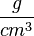 nennt man Leichtmetalle. Darüber sind es Schwermetalle. nennt man Leichtmetalle. Darüber sind es Schwermetalle.
|
Berechnungen mit der Dichte
Informationen und Aufgaben zu Berechnungen mit der Dichte gibt es auf einer Unterseite.
Bedeutung der Dichte für den Auftrieb
|
Das Bild rechts zeigt verschiedene flüssige und feste Stoffe übereinander. Von oben nach unten sind es:
|
100px |
| Flüssige Stoffe ordnen sich in einem Gefäß immer so an, dass der Stoff mit der geringsten Dichte am weitesten oben ist.
Feste Stoffe können in einer Flüssigkeit ...
Dies gilt natürlich nur, wenn die Stoffe sich nicht vermischen oder ineinander löslich sind. |
| VERSUCH:
Erhitzen von festem Wachs und Wasser 1.) Wachs: Erhitze Wachs in einem Gefäß, so dass es schmilzt. Du kannst dazu zum Beispiel eine Teelicht auf die Herdplatte stellen und auf kleinster Stufe erhitzen. Erhitze nicht so stark, dass es raucht - dieser Wachsdampf könnte sich selbst entzünden! Bevor alles geschmolzen ist, sollte noch ein kleines Stück Wachs übrig sein. Wie "liegt" es im flüssigen Wachs? Liegt es auf dem Boden oder schwimmt es? 2.) Gefrorenes Wasser: Erhitze auf gleiche Art und Weise Eis. Das Gefäß darf nicht zu flach sein! Wenn noch ein Stück festes Wasser im flüssigen Wasser übrigbleibt, wo ist dann das feste Wasser (also das Eis)? Liegt es auf dem Boden oder schwimmt es?
|
30px Aufgabe 2a
Bei dem Experiment, dass davor beschrieben wurde, geht es um die sogenannte Dichteanomalie des Wassers. Halte den Begriff im Heft fest und notiere, was an der Dichte von Wasser anders ist als bei den anderen Stoffen. Falls du das Experiment nicht durchgeführt hast kannst du dir auch den 15px Video anschauen. |
30px Aufgabe 2b
Was hat die Dichteanomalie hiermit zu tun? Und welche Bedeutung hat das für die Überlebensfähigkeit von Wasserbewohnern.
|
30px Aufgabe 3
Der Mann kann im Toten Meer bequem die Zeitung lesen, ohne unterzugehen. Wie du vielleicht weißt, ist das Wasser im Toten Meer sehr salzig. Wie wirkt sich das Salz offensichtlich aus? |
Abschluss
30px Aufgabe 4
Finde die typischen Fehler in den Aussage und korrigiere sie. Die richtige Lösung ist versteckt und kann zur Kontrolle nachgeschaut werden.
|
Schmelz- und Siedetemperaturen
| 50px | Im Buch zu lesen: Zum Thema Aggregatzustände findest du in unserem Buch Informationen auf der Seite 26. |
Die Schmelz- und Siedetemperaturen sind sehr typische Eigenschaften anhand denen man häufig schon Stoffe erkennen kann. Sie bestimmen auch, welche Aggregatzustand ein Stoff bei Normal- oder Raumtemperatur (offiziell auf 25°C festgelegt) hat.
Es gibt die drei Aggregatzustände: Fest, Flüssig und Gasförmig. Die Übergänge zwischen den Aggregatzustände haben spezielle Namen. Es gibt allgemeine Bezeichnungen (linkes Bild) und solche, die wir meist beim Wasser (rechtes Bild) verwenden.
| 400px | Datei:Aggregatzustaende.png |
Alle Übergänge können am Beispiel Wasser im Alltag beobachtet werden:
- Schmelzen
- Schnee oder Eis fängt im Frühjahr an flüssig zu werden, sobald Temperaturen oberhalb der Schmelztemperatur herrschen.
- Erstarren
- Kühlt das Wasser in Seen unter den Gefrierpunkt ab, bilden sich Eiskristalle, die mit der Zeit immer größer werden, bis die Oberfläche mit einer Eisschicht überzogen ist.
- Verdampfen
- Wird Wasser im Kochtopf über seine Siedetemperatur erhitzt, so wird das Wasser gasförmig. Das „Blubbern“ im Kochtopf kommt zustande, weil das Wasser am heißen Topfboden zuerst die Siedetemperatur erreicht - Die aufsteigenden Blasen sind der Wasserdampf, der (wie die meisten gasförmigen Stoffe) unsichtbar ist. Verdunstung, der Übergang von flüssig in gasförmig ohne Erreichen der Siedetemperatur, ist bei Schweiß auf der Haut gut zu beobachten.
- Kondensieren
- Der deutlich sichtbare Nebel oberhalb kochenden Wassers, der meist umgangssprachlich als "Dampf" bezeichnet wird, ist zu winzigen Wassertröpfchen kondensierter Wasserdampf. Tau und Wolken entstehen ebenfalls durch kondensierenden Wasserdampf.
- Sublimation
- gefrorenen Pfützen können im Winter, auch bei Temperaturen weit unterhalb des Gefrierpunktes, durch Sublimation nach und nach "austrocknen", bis das Eis vollständig sublimiert und die Pfütze verschwunden ist.
- Resublimation
- Raureif oder Eisblumen, die sich im Winter bilden, entstehen durch den aus der Umgebungsluft resublimierenden Wasserdampf.
|
30px Aufgabe 5
Lerne die Begriffe für die Übergänge zwischen den Aggregatzuständen, wenn du sie noch nicht kennst. Dazu gehört auch die Bedeutung der Schmelz- und Siedetemperatur in diesem Zusammenhang. Tipp: Zeichne dir ein ähnliches Diagramm (wie das linke hier) ins Heft.
|
30px Aufgabe 6
Bearbeite das Arbeitsblatt. Trage die Begriffe ein, wo man Übergänge zwischen den Aggregatzuständen hat. Färbe die Pfeile auch rot oder blau.
|
30px Aufgabe 7
Welchen Aggregatzustand haben die folgenden Stoffen bei 200°C? Halte im Heft nach dem Stoffnamen die Schmelz- und Siedetemperatur fest und dann, wie der Aggregatzustand bei 200° ist:
Welchen Aggregatzustand haben die folgenden Stoffen bei -150°C?
|
| VERSUCH:
Bestimme Schmelz- und Siedetemperaturen von verschiedenen Stoffen
Du kannst Schmelz- (bzw. Erstarrungstemperatur) und Siedetemperaturen bestimmen. Im Buch findest du Anleitungen, wie du vorgehen musst. Folgende Stoffe haben wir zur Verfügung:
Beim Experimentieren musst du regelmäßig Zeitpunkt und Temperatur aufschreiben. Diese Werte können dann entweder von Hand oder mit einer Tabellenkalkulation als Liniendiagramm gezeichnet werden. |
Löslichkeit in Wasser und anderen Flüssigkeiten
...



