Heizen und Antreiben: Unterschied zwischen den Versionen
| Zeile 184: | Zeile 184: | ||
}} | }} | ||
| − | + | ||
== Brandbekämpfung - praktisch und theoretisch == | == Brandbekämpfung - praktisch und theoretisch == | ||
| Zeile 192: | Zeile 192: | ||
<center>[[Datei:Verbrennungsdreieck.svg]]</center> | <center>[[Datei:Verbrennungsdreieck.svg]]</center> | ||
| + | <!-- | ||
== Warum reagieren Stoffe miteinander? == | == Warum reagieren Stoffe miteinander? == | ||
| Zeile 199: | Zeile 200: | ||
Offensichtlich stellt diese Anzahl einen stabilen Zustand dar, denn Edelgase sind sehr reaktionsträge und bilden fast keine Verbindungen.}} | Offensichtlich stellt diese Anzahl einen stabilen Zustand dar, denn Edelgase sind sehr reaktionsträge und bilden fast keine Verbindungen.}} | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==== Reaktion von Natrium mit Chlor - wo ist da Energie im Spiel ==== | ==== Reaktion von Natrium mit Chlor - wo ist da Energie im Spiel ==== | ||
Version vom 23. November 2017, 22:29 Uhr
Heizen und Antreiben? ... was hat das mit Chemie zu tun?
Drei wichtige Aspekte, die wir bisher schon bei den anderen Themen angesprochen haben, bringen hier Chemie ins Spiel:
- Welche Stoffe eigenen sich zum Heizen und Antreiben? Was sind ihre typischen Eigenschaften, die bei der Verwendung eine Rolle spielen?
- Welche chemischen Reaktionen laufen bei der Benutzung ab?
- Können wir die Eigenschaften und die Reaktionen auf atomarer Ebene erklären?
Ein wichtiger Aspekt, der hier eine Rolle spielt, den wir bisher noch nicht so intensiv betrachtet haben, ist das Thema "Energie". Dazu eine erste Übung.
Inhaltsverzeichnis |
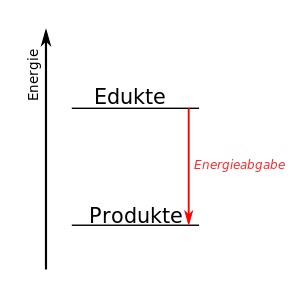
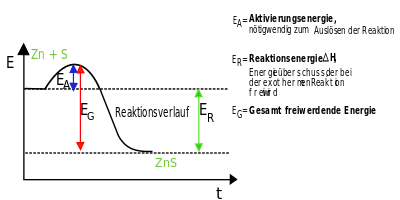
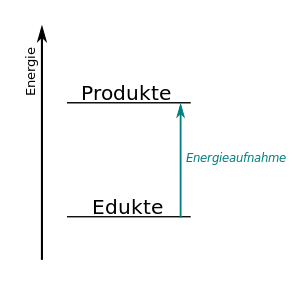
Energie bei chemischen Reaktionen
30px Aufgabe 1
Bei den in den folgenden Informationen beschriebenen Vorgängen, finden immer auch chemische Reaktionen statt. Teilweise sogar zwei chemische Reaktionen. Bei allen ist die Umsetzung von Energie von großer Bedeutung.
Die Texte können mit Aufgaben als pdf hier heruntergeladen werden. |
- Die Photosynthese ist ein Prozess, bei dem Lichtenergie durch Lebewesen in chemische Energie umgewandelt wird und organische Stoffe synthetisiert werden. ... Die Synthese dieser Stoffe geht überwiegend von der sehr energiearmen anorganischen Kohlenstoff-Verbindung Kohlenstoffdioxid aus. Aus Kohlenstoffdioxid und Wasser entsteht – durch Energiezufuhr (Licht) – Traubenzucker (Glucose) und Sauerstoff.
Material 2: Chemische Energie
Verwendung chemischer Energie in technischen Systemen
- Aus technischer Sicht ist in Treibstoffen chemische Energie gespeichert, die durch deren Verbrennung, etwa beim Antrieb von Fahrzeugen, in mechanische Energie umgewandelt wird. Brennstoffzellen erlauben den Wandel von chemischen Reaktionsenergie einer Verbrennung direkt in elektrische Energie. Bei Nutzung von Batterien wird über elektrochemische Reaktionen die chemische Energie direkt in elektrische Energie gewandelt. Ein Akkumulator verhält sich bei der Nutzung der Energie ähnlich wie eine Batterie, kann aber auch umgekehrt elektrische Energie in chemische wandeln und so speichern.
Verwendung chemischer Energie in biologischen Systemen
- Aus biologischer Sicht ist in organischer Nahrung chemische Energie gespeichert, die in ATP als Energieträger umgewandelt wird. Grüne Pflanzen beziehen ihre chemische Energie nicht aus organischer Nahrung, sondern aus dem Energiegehalt der Sonnenstrahlung ...
Material 3: Bleiakku
- Bei einem Bleiakkumulator (kurz Bleiakku, besonders beim Kfz auch Starterbatterie) handelt es sich um eine Ausführung des Akkumulators, bei der die Elektroden aus Blei und der Elektrolyt aus verdünnter Schwefelsäure besteht.
- Bei der Entladung reagiert Blei mit Sauerstoff zu Bleioxid und löst sich im Elektrolyt auf. Beim Laden wird die Reaktion umgekehrt und es entsteht wieder metallisches Blei.
Material 4: Wasserstoff als Energieträger der Zukunft
- Wasserstoff scheint eines der Energieträger der Zukunft zu sein. Besonders sauber wird er hergestellt, wenn der für die Aufspaltung von Wasser in Wasserstoff und Sauerstoff benötigte Strom mit Hilfe von Solarzellen gewonnen wird.
- Wird das gasförmige Wasserstoff unter Druck verflüssigt, so kann man ihn auch in Tanks füllen und als Treibstoff verwendet werden. Dabei kann der Wasserstoff direkt mit Sauerstoff verbrannt werden oder die, in ihm enthaltene Energie, wird mit Hilfe einer sogenannten Brennstoffzelle in elektrischen Strom verwandelt werden. Und die „Abgase“? Als einziges Reaktionsprodukt entsteht Wasserdampf.
30px Aufgabe 2
Lies im Buch (Chemie heute I) die Seiten 73 und 75 bis 77 und halte die neuen Begriffe mit Definitionen fest, die mit dem Aspekt des Energieumsatzes bei chemischen Reaktionen zu tun haben.
|
30px Aufgabe 3
Um die neuen Begriffe gleich anwenden zu können gibt es ein Zuordnungsquiz. |
Energie aus physikalischer Sicht
| Bei Energie denkt man sicher zuerst an Strom. Sicher bekommt ihr mit, dass andauernd der Begriff Energie in den Nachrichten vorkommt: Energie sparen, Alternative Energie, fossile Energie, Sonnenenergie, ...
Für die Physiker ist der Begriff Energie von wichtiger Bedeutung. Auch wenn das Thema im Physik-Unterricht erst später durchgenommen wird, so solltet ihr vorab ein paar Dinge dazu wissen.
|
30px Aufgabe 5
Den physikalische Aspekt der Energieumwandlungen bei chemischen Reaktion kannst du in einem weiten Quiz noch mal anwenden, bei dem ein paar Filme vorgegeben sind. Zu jedem Film gibt es dann ein paar MultipleChoice-Fragen. |
Experimente zur Energie bei chemischen Reaktionen
30px Aufgabe 1
Führe die drei Experimente durch und betrachte die Videos zu den Experimenten, die du nicht selber durchführen kannst. Mache dir zu jedem Experiment Notizen über die Beobachtungen. Diese Notizen sollen dann zusammen mit den Begriffen zum Energie-Umsatz bei chemischen Reaktionen zur Beantwortung der Fragen unten dienen. |
| VERSUCH: (1) Kupfersulfat und Wasser
Verwende bei beiden Versuchen eine Schutzbrille! ACHTUNG: 19px Kupfersulfat ist umweltgefährdend und darf deshalb nicht in den Abfluss! Hände nach dem Experiment waschen. Versuch 1: Erhitze in einem waagrecht eingespannten Reagenzglas etwas "blaues Kupfersulfat" (= Kupfersulfat-Hydrat). Beobachte die Farbe des Pulvers bzw. deren Veränderung und die Wand des Reagenzglases im nicht erhitzten Teil. Versuch 2: Versetze in einer kleinen Porzellanschale eine Spatelspitze weißes Kupfersulfat mit wenigen Wassertropfen aus der Plastikpipette und beobachte die Veränderung von Farbe und Temperatur! Nutze die aufgebauten Geräte und schaue dir noch einmal die Bilder an, die zeigen, wie das Experiment durchgeführt werden soll. Aufräumen: Gib das erhitzte bzw. mit Wasser versetzte Kupfersulfat jeweils in das passende Behältnis und "lege" wieder alle Geräte zurück. Ein Auswaschen ist notwendig. Es reicht die Reste aus zu schütten/klopfen/kratzen. |
| VERSUCH: (2) Verschiedene Metallpulver verglühen lassen
Du sollst in diesem Experiment vergleichen, wie heftig die Reaktion verschiedener Metalle beim Verbrennen ist. Schutzbrille verwenden! Sind die Hände gewaschen? Dazu soll das Metallpulver in die Bunsenbrennerflamme gepustet werden. Gehe jeweils so vor:
Für jedes Metall sollte ein eigener Strohhalm vorhanden sein! Bitte geht sparsam mit dem Material um. Das Metallpulver ist nicht so sehr billig! Pro Metall sollten zwei Versuche mit kleinen Mengen reichen! Aufräumen: Kehrt den Bereich des Experimentes, damit kein Metallpulver mehr herumliegt. Schaltet den Bunsenbrenner ganz aus, wenn keine Gruppe direkt nach euch dran ist. |
| VERSUCH: (3) Vergleich der Reaktion verschiedener Metalle mit Schwefel
Schau dir die folgenden Experimente an, bei denen Schwefel mit verschiedenen Metallen reagiert. Du findest auf den verlinkten Seiten jeweils den Film sowie noch einmal Bilder aus dem Film, wo die wichtigsten Momente noch einmal festgehalten sind. Es lohnt sich meist die Filme größere anzuschauen und auch die Bilder darunter noch einmal zu betrachten und die Erklärungen durchzulesen. |
| VERSUCH: (4) Kettenreaktion
Betrachte dir dieses Video, in dem man eine Kettenreaktion beobachten kann. 15px
Überlege dir dazu folgendes und notiere es:
|
| VERSUCH: (5) Zucker verbrennt mit Hilfe von Asche
Verwende bei beiden Versuchen eine Schutzbrille! Nimm eines der frischen Würfelzuckerstückchen. Versuch 1: Nutze den kleinen Gasbrenner und versuche den Zucker auf der unbrennbaren Unterfläche zu entzünden, indem du ihn stark erhitzt. Versuch 2: Gib nun etwas von der Asche auf das Zuckerstücken und versuche erneut den Zucker entzünden. Es sollte kein Haufen Asche sein, sondern dünn über die Zuckeroberfläche verteilt werden. Ein ähnliches Experiment kannst du dir 15px hier ansehen. Das solltest du auch tun, da man hier noch besser die Wirkung der Asche beobachten kann. |
Brandbekämpfung - praktisch und theoretisch
Ein Feuer kann nur brennen, wenn alle drei Bedingungen erfüllt sind: