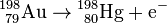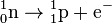Oberstufe: Unterschied zwischen den Versionen
(→Elemente des Lebens) |
(→Alte Themen) |
||
| (56 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | [[/Infos für den | + | |
| + | '''Bücher und andere Nachschlage-Werke''' | ||
| + | |||
| + | Wir nutzen in der Oberstufe aktuell das Werk '''Chemie heute SII''' <small>(Abkürzung CH)</small> von Schroedel. | ||
| + | :''Es wird euch vor allem als Wissensquelle zum Nachlesen der Theorie dienen. Ich werde euch bei Bedarf dann auf die passenden Seiten hinweisen.'' | ||
| + | |||
| + | Um nicht zu theorie-bezogen zu arbeiten würde ich gerne das Lehr-Werk '''Salters Chemie''' nutzen. | ||
| + | :* Zum einen gibt es das Buch '''Salters Chemie - Chemical storylines''' <small>(Abkürzung CS)</small>. Das Buch gibt es online ([http://flashbook.schroedel.de/salters-chemie-978-3-507-12201-7#/0 hier]) zu lesen. Das Lesen der Texte, wenn wir es nicht in der Schule gemeinsam tun, ist das immer Hausaufgabe. Im Text eingebettet (''mit einem größeren gelben Pfeil'') gibt es immer wieder Hinweise zu der benötigten Theorie und Aktivitäten (also Experimente, Aufgaben, ... usw.). | ||
| + | :* Das Theorie zu den Geschichten liefert normalerweise '''Saltes Chemie - Chemical Ideas''' <small>(Abkürzung CI)</small>. Als Ersatz dafür verwenden wir das Buch '''Chemie heute''', zu dem ich immer die passenden Seiten angeben werden. '''Chemical Ideas''' kann freiwillig als Ergänzung online gelesen werden, denn es ist ebenfalls Flashbook online [http://flashbook.schroedel.de/salters-chemie-978-3-507-12202-4#/0 hier] verfügbar. Die passenden Seiten sind im CS-Buch jeweils angegeben. | ||
| + | |||
| + | *[[/Gk 2013-2016 - Inhalt Arbeiten/]] [[/Infos für den Grundkurs/|+]] | ||
| + | *[[/Gk 2015-2018 - Inhalt Arbeiten/]] | ||
= Salters = | = Salters = | ||
| − | == Elemente des Lebens == | + | == Modul EL - Elemente des Lebens == |
| − | + | === Atomaufbau und Kernreaktionen === | |
| + | ==== Wiederholung Kern-Hülle-Modell ==== | ||
| + | Das hier folgende App dient der Übung zur Anzahl der Elementarteilchen. Wer sich fit fühlt, kann gleich die "Spiele" ausprobieren. Ansonsten könnte man ein wenig herumspielen und versuchen, sich daran zu erinnern, wie der Zusammenhang zwischen Protonen, Neutronen und Elektronen bei Atomen und geladenen Teilchen, den Ionen, ist. | ||
| + | <iframe src="http://phet.colorado.edu/sims/html/build-an-atom/latest/build-an-atom_en.html" width="800" height="600" allowfullscreen></iframe> | ||
| + | |||
| + | [[Datei:Li6-D_Reaction.svg|miniatur|Beispiel einer Kernreaktion: <math>{}^{6}_{3}\mathrm{Li}+{}^{2}_{1}\mathrm{H}\rightarrow2\ {}^{4}_{2}\mathrm{He}</math>]] | ||
| + | |||
| + | ==== Kernreaktionen/Radioaktiver Zerfall ==== | ||
| + | [http://atom.kaeri.re.kr:8080/nuchart/ Nuklid/Isotopen-Karte] | ||
| + | |||
| + | |||
| + | [[Datei:Alfa_beta_gamma_radiation.svg|thumb|right|Die Strahlungsarten und ihre unterschiedlichen Eindringtiefen.]] | ||
| + | |||
| + | Es werden drei hauptsächliche ''Zerfallsarten'' unterschieden: Alpha-, Beta- und Gamma-Zerfall. Da man zum Zeitpunkt ihrer Entdeckung noch nicht wusste, um welche Vorgänge es sich handelte, bezeichnete man die 3 Strahlenarten einfach in der Reihenfolge zunehmenden Durchdringungsvermögens mit den ersten 3 Buchstaben des griechischen Alphabets. | ||
| + | |||
| + | Die bei den Kernreaktionen freiwerdenden Energie lassen sich mit Massendefekten erklären, die auch 1930 experimentell nachgewiesen wurden. Die "verschwundene" Masse wird in Energie umgewandelt und lieferte damit den Beweis für das 1905 von Albert Einstein im Rahmen der speziellen Relativitätstheorie entdeckte Naturgesetz. Es besagt, dass die Masse m und Ruheenergie E eines Objekts zueinander proportional sind: <math>E \;=\; m \,c^{2}</math> | ||
| + | |||
| + | |||
| + | * Beim '''Alpha-Zerfall''' verringern sich durch die Emission eines Alpha-Teilchens, bestehend aus zwei Protonen und zwei Neutronen, die Ordnungszahl des Atomkerns um 2 und die Massenzahl um 4. | ||
| + | :in etwas kräftigeres Blatt Papier oder einige Zentimeter Luft reichen somit im Allgemeinen schon aus, um Alphateilchen vollständig abzuschirmen. In einer Nebelkammer sehen die durch Alphastrahlung erzeugten Bahnspuren, verglichen mit denen von Betastrahlen ähnlicher Energie, kürzer und dicker aus. | ||
| + | :Alphastrahlung, die von außen auf den menschlichen Körper wirkt, ist selbst relativ ungefährlich, da die Alphateilchen aufgrund ihrer geringen Eindringtiefe überwiegend nur in die oberen, toten Hautschichten eindringen. Ein im Organismus durch Einatmen oder Aufnahme mit der Nahrung eingelagerter Alphastrahler ist dagegen sehr schädlich, da in diesem Fall nicht die toten Hautschichten, sondern lebende Zellen geschädigt werden. Insbesondere die Anreicherung eines mit Alphastrahlung zerfallenden Nuklids in einem Organ führt zu einer hohen Belastung dieses Organs, da dabei eine hohe Strahlendosis ihre schädigende Wirkung auf kleinem Raum und auf wichtige Körperzellen ausübt (Strahlenkrankheit). | ||
| + | :Ein konkretes Beispiel für einen Alpha-Zerfall ist: | ||
| + | :: <math>{}^{146}_{\ 62} \mathrm {Sm} \to {}^{142}_{\ 60} \mathrm {Nd} + {}^{4}_{2} \mathrm {He} + 2{,}45\, \mathrm{MeV} </math>. | ||
| + | |||
| + | <center> | ||
| + | {| class="wikitable" | ||
| + | |- | ||
| + | | Emission eines Alphateilchens (Protonen rot, Neutronen blau) || [[Datei:Alpha Decay.svg|250px]] | ||
| + | |- | ||
| + | | Ein Plutonium-Pellet (<sup>238</sup>Pu) glüht durch seinen eigenen Zerfall.|| [[Datei:Plutonium pellet.jpg|250px]] | ||
| + | |} | ||
| + | </center> | ||
| + | |||
| + | |||
| + | * Beim '''Beta-Zerfall''' wird aus dem Atomkern ein Elektron oder Positron emittiert; ein im Atomkern vorhandenes Neutron wandelt sich in ein Proton um oder umgekehrt. Hierdurch ändert sich die Ordnungszahl um 1, die Massenzahl bleibt gleich. | ||
| + | :Ein typischer β<sup>−</sup>-Strahler ist [<sup>198</sup>Au. Hier lautet die Umwandlung in Formelschreibweise: | ||
| + | ::<math>{}^{198}_{\ 79} \mathrm {Au} \to {}^{198}_{\ 80} \mathrm {Hg} + \mathrm{e}^{-}</math> | ||
| + | :Die dabei stattfindende Umwandlung eines Neutrons in ein Proton und Elektron kann man so beschreiben: | ||
| + | ::<math>{}^{1}_{0} \mathrm {n} \to {}^{1}_{1} \mathrm {p} + \mathrm{e}^{-} </math> | ||
| + | <center> | ||
| + | {| class="wikitable" | ||
| + | |- | ||
| + | | [[Datei:Beta-minus Decay.svg|300px]]) || β−-Strahlung (Protonen rot, Neutronen blau) | ||
| + | |} | ||
| + | </center> | ||
| + | :Ist der menschliche Körper Betastrahlen ausgesetzt, werden nur Hautschichten geschädigt. Dort kann es aber zu intensiven Verbrennungen und daraus resultierenden Spätfolgen wie Hautkrebs kommen. Sind die Augen der Strahlung ausgesetzt, kann es zur Linsentrübung kommen. | ||
| + | :Werden Betastrahler in den Körper aufgenommen (man nennt das inkorporiert), können hohe Strahlenbelastungen in der Umgebung des Strahlers die Folge sein. Gut dokumentiert ist Schilddrüsenkrebs als Folge von radioaktivem Iod-131 (131I), das sich in der Schilddrüse sammelt. In der Literatur findet man auch Befürchtungen, dass Strontium-90 (90Sr) zu Knochenkrebs und Leukämie führen kann, da sich Strontium wie Calcium in den Knochen anreichert. | ||
| + | |||
| + | |||
| + | * Ein '''Gamma-Zerfall''' tritt meist als unmittelbare Folge eines Alpha- bzw. Beta-Zerfalls auf. Massen- und Ordnungszahl bleiben dabei gleich, jedoch ändert sich der Anregungszustand des Kerns. | ||
| + | :Im weiteren Sinne wird mit Gammastrahlung jede elektromagnetische Strahlung mit Energien über etwa 200 keV bezeichnet, unabhängig von der Art ihrer Entstehung. | ||
| + | <center> | ||
| + | {| class="wikitable" | ||
| + | |- | ||
| + | | [[Datei:Gamma Decay.svg|300px]]) ||ɣ-Strahlung, es wird keine Materie frei, sondern nur elektromagnetische Strahlung. | ||
| + | |} | ||
| + | </center> | ||
| + | :Wird Gammastrahlung in menschlichem, tierischem oder pflanzlichem Gewebe absorbiert, wird ihre Energie in Ionisations- und anderen Vorgängen wirksam. Dabei treten im Gewebe Sekundärstrahlungen wie freigesetzte Elektronen und Röntgenstrahlung auf. Insgesamt ergeben sich – für den Organismus meist schädliche – Wirkungen durch das Aufbrechen chemischer Bindungen. Die Folgen können am bestrahlten Organismus selbst (somatische Schäden) oder, durch Schädigung des Erbguts, an seinen Nachkommen als genetische Schäden auftreten. | ||
| + | :Bei geladenen Teilchenstrahlungen nimmt die Intensität der Gammastrahlung mit der Eindringtiefe ab. Die Eindringtiefe hängt von der Wellenlänge der Gammastrahlung und von der Ordnungszahl des abschirmenden Materials ab: Blei ist deshalb das gängigste zum Strahlenschutz gegen Gammastrahlung verwendete Material. | ||
| + | |||
| + | ====Anwendungen der Radioaktivität==== | ||
| + | Es gibt einige Anwendung in der Medizin, siehe {{wpde|Nuklearmedizin|Nuklearmedizin}}. | ||
| + | |||
| + | '''Nutzung der Radioaktivität zu Altersbestimmung''' | ||
| + | ''... wie etwa die C14-Methoden/Radio-Kohlenstoff-Datierung'' | ||
* [[Frau Lachner/Halbwertzeit|Halbwertzeit]] | * [[Frau Lachner/Halbwertzeit|Halbwertzeit]] | ||
| + | |||
| + | === Woher wissen wir so viel über das Universum? === | ||
| + | '''Analysemethoden in der Chemie''' | ||
| + | |||
| + | {{Kurzregel|Die '''Titration''' ist ein Verfahren der '''quantitativen Analyse''' in der Chemie. Ein bekannter Stoff, dessen Menge/Konzentration aber unbekannt ist, wird durch Hereintröpfeln mit einer Maßlösung (bekannte Konzentration) in einer chemischen Reaktion umgesetzt. Das Volumen der verbrauchten Maßlösung wird gemessen und die Menge/Konzentration berechnet.}} | ||
| + | |||
| + | {{Kurzregel|Die '''Spektroskopie''' eine analytische Methode, die meist zur '''qualitativen Analyse''' eingesetzt wird. Dabei wird zum Beispiel das emitierte Lichtspektrum einer Probe mit einem Prisma aufgespalten und die sichtbaren Spektrallinien mit bekannten Spektren verglichen.}} | ||
| + | ::Mehr dazu auf der Unterseite [[Frau Lachner/Spektren|Spektren]]. | ||
| + | |||
| + | ==== Schalen-Modell - Wiederholung ==== | ||
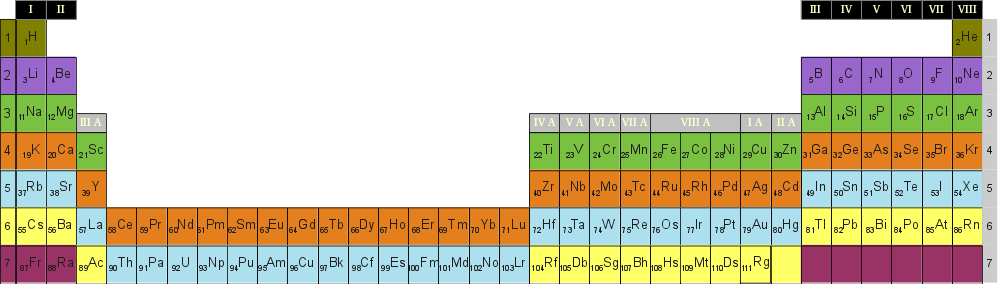
| + | [[Datei:Periodensystem_lang_mit_Farben_für_Schalen.png]] | ||
| + | |||
| + | Hier wird im Periodensystem farbig dargestellt, in welche Schale ein neues Elektron hinzukommt, im Vergleich zum Element mit einer um eins kleineren Ordnungszahl. | ||
| + | |||
| + | ====Verbindungen von Atomen - Ionen und MolekülVerbindungen==== | ||
| + | * [[Frau_Lachner/Übungen_zu_Ionenverbindungen|Wiederholung - Übungen zu Ionen]] | ||
| + | ** [http://tube.geogebra.org/material/simple/id/1149535 Zufällig erzeugte Aufgaben zur Bestimmung der Formel und des Namens von Ionenverbindungen.] | ||
| + | * Atombindungen ... warum das Schalenmodell nicht reicht! - [http://www.youtube.com/watch?v=Bm47gFdJ1TU Video] | ||
| + | * Erklärungen zur Herleitung des Kugelwolkenmodells - [http://www.youtube.com/watch?v=cCIhROJItss Video 1] und [http://www.youtube.com/watch?v=5fBKSanHzXw Video 2]. | ||
| + | |||
| + | ====Die Geometrie von Verbindungen==== | ||
| + | * [[Frau Lachner/Oberstufe/Geometrie von Verbindungen|Geometrie von Verbindungen]] | ||
| + | |||
| + | === Wiederholung aus der Mittelstufe zur verschiedenen Themen === | ||
| + | * '''Stöchiometrie:''' [http://www.youtube.com/watch?v=5UMIdqp8Lo0 Berechnung der Masse von Teilchen] - [http://www.youtube.com/watch?v=bC87BoPVzcg Berechnung der Molmasse] - [http://www.youtube.com/watch?v=pq-zYnRBHnc Benutzung des Übersichtsblattes zu den Maßangaben] | ||
| + | * '''Symbolschreibweise, Reaktionsgleichungen:''' [http://www.youtube.com/watch?v=lTB5jTl1alE Aufstellen und Ausgleichen von Reaktionsgleichungen] - [http://www.youtube.com/watch?v=Mr513nPX4yo Einfache Reaktionsgleichungen ausgleichen] - [http://www.youtube.com/watch?v=ituWTYAXdrs Sehr schwere Reaktionsgleichungen ausgleichen] | ||
| + | * '''Lewisschreibweise:''' [http://www.youtube.com/watch?v=WQze3CdCTk0 Lewis-Schreibweise bei Molekülen] - [http://www.youtube.com/watch?v=EwX-EIl61CI Atombindung und Lewis-Schreibweise] | ||
| + | |||
| + | |||
| + | {{Aufgabe|Dieses [http://wikis.zum.de/chemie-digital/images/4/49/St%C3%B6chiometrie-Aufgaben-Sch%C3%BCler-Download-Variante.pdf '''Dokument'''] enthält Übungen zur Stöchiometrie mit allen Lösungen. Bearbeitet sie selbstständig und kontrolliert sie selber. Treten Fragen bei konkreten Aufgaben auf, so können diese Fragen gestellt werden, indem der eigene Lösungsansatz vorgestellt wird. | ||
| + | |||
| + | '''Hinweis: Natürlich kann es vorkommen, das die von mir erstellten Lösungen Fehler enthalten. Bitte teilt mir diese dann mit!''' | ||
| + | }} | ||
| + | |||
| + | == Modul ET - Entwicklung von Treibstoffen == | ||
| + | === Energie bei chemischen Reaktionen === | ||
| + | |||
| + | '''Daten:''' Enthalpie-Werte wie zum Beispiel ... | ||
| + | :* [http://de.wikibooks.org/wiki/Tabellensammlung_Chemie/_Enthalpie_und_Bindungsenergie#Bindungsenergie_.2F_Dissoziationsenergie Bindungsenergie] | ||
| + | |||
| + | Hier ein paar Videos ''(zunächst erst einmal zwei Stück)'' zu Energetische Betrachtung von chemischen Reaktionen: | ||
| + | # [https://www.youtube.com/watch?v=dZydf3sA418 Allgemeines zum Thema Energie] | ||
| + | # [https://www.youtube.com/watch?v=AhDzlM6Y9yI Vergleich der Enthalpie-Arten] | ||
| + | |||
| + | === Erdölverarbeitung === | ||
| + | |||
| + | * {{Video}} zur [http://www.youtube.com/watch?v=TxNXV-Yf-Jw%20Film%20zur%20 fraktionierten Erdöl-Destillation] | ||
| + | |||
| + | |||
| + | === Oktanzahl === | ||
| + | |||
| + | {{Aufgabe|1=Nutze das in der Schule installierte Programm '''Avogadro''', um Alkane zu zeichnen, wie sie in der Aufgabe angegeben sind. | ||
| + | Wie das Programm Avogadro funktioniert, wird in den folgenden Videos erklärt. ''[http://avogadro.openmolecules.net/wiki/Main_Page Download-Seite] für zu Hause.'' | ||
| + | |||
| + | Zur Aufgabenstellung im Arbeitsauftrag 7 auf Seite 34: | ||
| + | * Öffne ein Text-Dokument und erstelle eine Tabelle mit den folgenden Spalten: | ||
| + | ** Name des Alkans, Summenformel, Lewisschreibweise , Octanzahl, Kugelstab-Modell, Kalottenmodell | ||
| + | :::<small>'''Hinweis:''' Man erhält ein Kalottenmodell in Avogadro, indem man als Darstellungsart "Van-der-Waals-Radien" verwendet. </small> | ||
| + | * Das Kugelstab-Modell und das Kalottenmodell sollen in Avogadro gezeichnet werden und per Screenshot in die Textverarbeitung eingefügt werden. | ||
| + | ** Nutzt dazu in der Schule das Programm "ksnapshot", zu dem es ein kurzes {{Video}} [http://www.youtube.com/watch?v=3s2ionQ9Pbw Video als Anleitung] gibt. | ||
| + | * Der Name wird normal eingetragen. | ||
| + | * Die Lewisschreibweise soll nach Ausdruck von Hand eingefügt werden. | ||
| + | }} | ||
| + | |||
| + | {| | ||
| + | |- | ||
| + | | '''Vorstellung von Avogadro (1)''' | ||
| + | || '''Vorstellung von Avogadro (2)''' | ||
| + | |- | ||
| + | | Im ersten Teil der Reihe wird gezeigt, wie man in Avogadro Moleküle zeichnet, diese von verschiedenen Seite betrachten kann und bearbeitet. | ||
| + | || Es wird gezeigt, wie man Benzol zeichnen kann. Zwischendurch wird bei Cyclohexan gezeigt, dass man verschiedene Konformere zeichnen kann. Und dann werden verschiedene Darstellungsarten gezeigt, wie auch eine Art Kalottenmodell. | ||
| + | |- | ||
| + | |{{#ev:youtube|8LZqlNjivlU}} | ||
| + | ||{{#ev:youtube|MTOYv5qCxQw}} | ||
| + | |} | ||
| + | |||
| + | {| | ||
| + | |- | ||
| + | | '''Funktionsweise des Otto-Viertakt-Motors''' || || '''Funktionsweise des Diesel-Viertakt-Motors''' | ||
| + | |- | ||
| + | | <iframe width="560" height="314" src="https://www.youtube.com/embed/C0unbau0yXc?rel=0&showinfo=0" frameborder="0" allowfullscreen></iframe> || ||<iframe width="560" height="314" src="https://www.youtube.com/embed/j19ya4XRLjQ?list=PLlkuDHDi_0RWcq4CK6PkMksWIq4eDsght&showinfo=0" frameborder="0" allowfullscreen></iframe> | ||
| + | |} | ||
| + | |||
| + | '''Unterschied zwischen Diesel und Benzin''' | ||
| + | |||
| + | <iframe width="560" height="314" src="https://www.youtube.com/embed/5tTQ5iTrD4Y?rel=0&showinfo=0" frameborder="0" allowfullscreen></iframe> | ||
| + | |||
| + | |||
| + | Ein Überblick zum Thema [[/Oktanzahl/]]. | ||
| + | |||
| + | Für Interessierte: [https://www.youtube.com/watch?v=KEwn8YNrgx8 Terra X - Das Diesel Rätsel] | ||
| + | |||
| + | == Modul Q: Aus tiefen Quellen == | ||
| + | |||
| + | * [[Frau Lachner/Oberstufe neu/Gewinnung von Brom am Toten Meer|Inhalt wurde ausgelagert auf neue Seite]] | ||
| + | |||
| + | == Modul WM - Entwicklung von Arzneimitteln == | ||
| + | |||
| + | Doppelspalt-Experiment: | ||
| + | * [https://www.youtube.com/watch?v=h9X5OMTetqI Das Mysterium - Quantenbewusstsein] | ||
| + | * [https://www.youtube.com/watch?v=GOQiz4rQd_Q 01 Das Reich der Quanten und Elementarteilchen] | ||
| + | |||
| + | Elektronen als stehende Wellen in Elektronenschalen | ||
| + | * [https://tube.geogebra.org/student/m13166 Bohr und de Broglie] | ||
| + | ::De Broglie gilt als einer der bedeutendsten Physiker des 20. Jahrhunderts, der für seine Entdeckung der Wellennatur des Elektrons (Welle-Teilchen-Dualismus) in seiner Dissertation 1929 den Nobelpreis für Physik erhielt. | ||
| + | |||
| + | [[File:Vibration corde trois modes petit.gif]] | ||
| + | |||
| + | * [https://www.uni-ulm.de/fileadmin/website_uni_ulm/nawi.inst.251/Didactics/quantenchemie/html/SchroedF.html Schrödinger-Gleichung] | ||
| + | |||
| + | === Orbital-Modell === | ||
| + | [[Orbitalmodell/Doppelbindung_beim_Ethen|Doppelbindung beim Ethen]] - Seite mit Erklärungen usw. | ||
| + | |||
| + | == Modul M - Maßgeschneiderte Materialein == | ||
| + | |||
| + | === Polyester === | ||
| + | Wichtige Poylester sind ... | ||
| + | * '''PET = {{wpde|Polyethylenterephthalat|Polyethylenterephthalat}}''' | ||
| + | <center>[[Datei:PET_Structural_Formula_V1.svg|350px]]</center> | ||
| + | ::Die Monomere, aus denen PET hergestellt wird, sind Terephthalsäure (1,4-Benzoldicarbonsäure) und Ethylenglycol (1,2-Dihydroxyethan, Ethan-1,2-diol). | ||
| + | <center>[[Datei:PET by Polycondensation V1.svg|500px]]</center> | ||
| + | ::[[File:Pet plastic crystallisation.jpg|thumb|Flaschenstück, das erhitzt und wieder abgekühlt wurde. Dabei fand eine Kristallisation statt.]]PET ist polar, wodurch starke zwischenmolekulare Kräfte vorhanden sind. Das Molekül ist zudem linear ohne Vernetzungen aufgebaut. Beides sind Voraussetzungen für teilkristalline Bereiche und Fasern. Durch diese Bereiche ergibt sich auch eine hohe Bruchfestigkeit und Formbeständigkeit bei einer Temperatur über 80 °C. | ||
| + | ::In der Lebensmittelindustrie wird PET bevorzugt eingesetzt. Es kann '''amorph''' verarbeitet werden und ist in dieser Form absolut farblos und von hoher Lichtdurchlässigkeit. Es wird für Lebensmittelverpackungen und Flaschen eingesetzt wie z. B. die PET-Flasche. | ||
| + | * '''PC = {{wpde|Polycarbonate|Polycarbonat(e)}}''' | ||
| + | <center>[[Datei:Polycarbonate.svg|200px]]</center> | ||
| + | ::Formal sind Polycarbonate alles Polyester der Kohlensäure. Hergestellt werden sie allerdings meist aus {{wpde|Phosgen|Phosgen}} und Diolen (also zweifach-Alkoholen). Die weitestverbreiteten Polycarbonate sind jene, welche Bisphenol A als Dihydroxykomponente und Phosgen verwenden. | ||
| + | <center>[[File:Polycarbonatsynthese.svg|800px]]</center> | ||
| + | ::Polycarbonate sind in der Regel amorph und weisen einen Kristallitanteil von weniger als 5 % auf. Sie zeichnen sich durch hohe Festigkeit, Schlagzähigkeit, Steifigkeit und Härte aus. Außerdem sind Polycarbonate gute Isolatoren gegen elektrischen Strom. | ||
| + | [[Datei:Interference-colors.jpg|miniatur|CD-Rohling aus Polycarbonat]] | ||
| + | ::Polycarbonat ist verhältnismäßig teuer. Es wird daher fast nur dort eingesetzt, wo andere Kunststoffe zu weich, zu zerbrechlich, zu kratzempfindlich, zu wenig formstabil oder nicht transparent genug sind. Darüber hinaus wird Polycarbonat als transparenter Kunststoff wie auch Polymethylmethacrylat (PMMA) oder Styrol-Acrylnitril (SAN) häufig als Glas-Alternative eingesetzt. Im Vergleich zum spröden Glas ist Polycarbonat leichter und deutlich schlagfester. | ||
| + | |||
| + | ==== Warum sind Kunststoffe transparent ? ==== | ||
| + | Bei Kunststoffen mit kristallinen Bereichen wird das Licht an der Grenzfläche der einzelnen Kristallikristallinen Bereiche gebrochen. Das Licht wird gebrochen und dabei abgelenkt. Außerdem haben die zwischen den Kristallen liegenden amorphen Gebiete haben eine andere optische Dichte. Durch die vielfache Brechung des einfallenden Lichts wird das Material dann opak oder undurchsichtig. | ||
| + | |||
| + | Durchgehend amorphe Polymere hingegen sind optisch gleichförmig. Das Licht wird nur einmal bei Eintritt und einmal bei Austritt aus dem Material gebrochen. | ||
| + | |||
| + | <center>[[File:Schematic_of_allotropic_forms_of_silcon_horizontal_plain.svg|400px]]</center> | ||
| + | |||
| + | Verstreckt man durchsichtige Kunststoffe so bilden sich meist kristalline Bereiche, die ja erwünscht sind, um die Stabilität zu erhöhen. Diesen Übergang vom amorphen zu teilkristallinen Verhalten kann man z.B. beobachten, denn beim Strecken erscheinen im Material weiße Schlieren. | ||
| + | |||
| + | == Polyurethane == | ||
| + | [[Datei:Polyurethane-allg.svg|300px|right]]'''Polyurethane''' (Kurzzeichen '''PUR'''; im Sprachgebrauch auch '''PU''') sind Kunststoffe, die aus der Polyadditionsreaktion von Dialkoholen (Diolen) beziehungsweise Polyolen mit Polyisocyanaten entstehen. Charakteristisch für Polyurethane ist die Urethan-Gruppe (<math>\mathrm{{-}NH{-}CO{-}O{-} \ }</math>). | ||
| + | |||
| + | [[Datei:Addition zu Polyurethan.svg]] | ||
| + | |||
| + | |||
| + | 1937 synthetisierte eine Forschergruppe um Otto Bayer in den Laboratorien der I.G. Farben in Leverkusen zum ersten Mal Polyurethane aus 1,4-Butandiol und Octan-1,8-diisocyanat und später aus Hexamethylendiisocyanat (Hexan-1,6-diisocyanat). | ||
| + | |||
| + | Hexamethylendiisocyanat. | ||
| + | [[Datei:Hexamethylene-diisocyanate-2D-skeletal.png]] | ||
| + | |||
| + | [[Datei:Polyaddition Polyurethane V.2.png]] | ||
| + | |||
| + | |||
| + | '''Toxizität''' Isocyanate können Allergien auslösen und stehen im Verdacht, Krebs zu verursachen. Wenn Polyurethane ausreagiert sind und keine Monomere mehr enthalten, besitzen sie in der Regel keine gesundheitsschädlichen Eigenschaften. | ||
= Alte Themen = | = Alte Themen = | ||
Aktuelle Version vom 15. Februar 2017, 16:22 Uhr
Bücher und andere Nachschlage-Werke
Wir nutzen in der Oberstufe aktuell das Werk Chemie heute SII (Abkürzung CH) von Schroedel.
- Es wird euch vor allem als Wissensquelle zum Nachlesen der Theorie dienen. Ich werde euch bei Bedarf dann auf die passenden Seiten hinweisen.
Um nicht zu theorie-bezogen zu arbeiten würde ich gerne das Lehr-Werk Salters Chemie nutzen.
- Zum einen gibt es das Buch Salters Chemie - Chemical storylines (Abkürzung CS). Das Buch gibt es online (hier) zu lesen. Das Lesen der Texte, wenn wir es nicht in der Schule gemeinsam tun, ist das immer Hausaufgabe. Im Text eingebettet (mit einem größeren gelben Pfeil) gibt es immer wieder Hinweise zu der benötigten Theorie und Aktivitäten (also Experimente, Aufgaben, ... usw.).
- Das Theorie zu den Geschichten liefert normalerweise Saltes Chemie - Chemical Ideas (Abkürzung CI). Als Ersatz dafür verwenden wir das Buch Chemie heute, zu dem ich immer die passenden Seiten angeben werden. Chemical Ideas kann freiwillig als Ergänzung online gelesen werden, denn es ist ebenfalls Flashbook online hier verfügbar. Die passenden Seiten sind im CS-Buch jeweils angegeben.
Salters
Modul EL - Elemente des Lebens
Atomaufbau und Kernreaktionen
Wiederholung Kern-Hülle-Modell
Das hier folgende App dient der Übung zur Anzahl der Elementarteilchen. Wer sich fit fühlt, kann gleich die "Spiele" ausprobieren. Ansonsten könnte man ein wenig herumspielen und versuchen, sich daran zu erinnern, wie der Zusammenhang zwischen Protonen, Neutronen und Elektronen bei Atomen und geladenen Teilchen, den Ionen, ist.
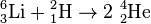
Kernreaktionen/Radioaktiver Zerfall
Es werden drei hauptsächliche Zerfallsarten unterschieden: Alpha-, Beta- und Gamma-Zerfall. Da man zum Zeitpunkt ihrer Entdeckung noch nicht wusste, um welche Vorgänge es sich handelte, bezeichnete man die 3 Strahlenarten einfach in der Reihenfolge zunehmenden Durchdringungsvermögens mit den ersten 3 Buchstaben des griechischen Alphabets.
Die bei den Kernreaktionen freiwerdenden Energie lassen sich mit Massendefekten erklären, die auch 1930 experimentell nachgewiesen wurden. Die "verschwundene" Masse wird in Energie umgewandelt und lieferte damit den Beweis für das 1905 von Albert Einstein im Rahmen der speziellen Relativitätstheorie entdeckte Naturgesetz. Es besagt, dass die Masse m und Ruheenergie E eines Objekts zueinander proportional sind: 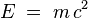
- Beim Alpha-Zerfall verringern sich durch die Emission eines Alpha-Teilchens, bestehend aus zwei Protonen und zwei Neutronen, die Ordnungszahl des Atomkerns um 2 und die Massenzahl um 4.
- in etwas kräftigeres Blatt Papier oder einige Zentimeter Luft reichen somit im Allgemeinen schon aus, um Alphateilchen vollständig abzuschirmen. In einer Nebelkammer sehen die durch Alphastrahlung erzeugten Bahnspuren, verglichen mit denen von Betastrahlen ähnlicher Energie, kürzer und dicker aus.
- Alphastrahlung, die von außen auf den menschlichen Körper wirkt, ist selbst relativ ungefährlich, da die Alphateilchen aufgrund ihrer geringen Eindringtiefe überwiegend nur in die oberen, toten Hautschichten eindringen. Ein im Organismus durch Einatmen oder Aufnahme mit der Nahrung eingelagerter Alphastrahler ist dagegen sehr schädlich, da in diesem Fall nicht die toten Hautschichten, sondern lebende Zellen geschädigt werden. Insbesondere die Anreicherung eines mit Alphastrahlung zerfallenden Nuklids in einem Organ führt zu einer hohen Belastung dieses Organs, da dabei eine hohe Strahlendosis ihre schädigende Wirkung auf kleinem Raum und auf wichtige Körperzellen ausübt (Strahlenkrankheit).
- Ein konkretes Beispiel für einen Alpha-Zerfall ist:
-
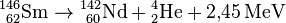 .
.
-
| Emission eines Alphateilchens (Protonen rot, Neutronen blau) | 250px |
| Ein Plutonium-Pellet (238Pu) glüht durch seinen eigenen Zerfall. | 250px |
- Beim Beta-Zerfall wird aus dem Atomkern ein Elektron oder Positron emittiert; ein im Atomkern vorhandenes Neutron wandelt sich in ein Proton um oder umgekehrt. Hierdurch ändert sich die Ordnungszahl um 1, die Massenzahl bleibt gleich.
- Ein typischer β−-Strahler ist [198Au. Hier lautet die Umwandlung in Formelschreibweise:
- Die dabei stattfindende Umwandlung eines Neutrons in ein Proton und Elektron kann man so beschreiben:
| 300px) | β−-Strahlung (Protonen rot, Neutronen blau) |
- Ist der menschliche Körper Betastrahlen ausgesetzt, werden nur Hautschichten geschädigt. Dort kann es aber zu intensiven Verbrennungen und daraus resultierenden Spätfolgen wie Hautkrebs kommen. Sind die Augen der Strahlung ausgesetzt, kann es zur Linsentrübung kommen.
- Werden Betastrahler in den Körper aufgenommen (man nennt das inkorporiert), können hohe Strahlenbelastungen in der Umgebung des Strahlers die Folge sein. Gut dokumentiert ist Schilddrüsenkrebs als Folge von radioaktivem Iod-131 (131I), das sich in der Schilddrüse sammelt. In der Literatur findet man auch Befürchtungen, dass Strontium-90 (90Sr) zu Knochenkrebs und Leukämie führen kann, da sich Strontium wie Calcium in den Knochen anreichert.
- Ein Gamma-Zerfall tritt meist als unmittelbare Folge eines Alpha- bzw. Beta-Zerfalls auf. Massen- und Ordnungszahl bleiben dabei gleich, jedoch ändert sich der Anregungszustand des Kerns.
- Im weiteren Sinne wird mit Gammastrahlung jede elektromagnetische Strahlung mit Energien über etwa 200 keV bezeichnet, unabhängig von der Art ihrer Entstehung.
| 300px) | ɣ-Strahlung, es wird keine Materie frei, sondern nur elektromagnetische Strahlung. |
- Wird Gammastrahlung in menschlichem, tierischem oder pflanzlichem Gewebe absorbiert, wird ihre Energie in Ionisations- und anderen Vorgängen wirksam. Dabei treten im Gewebe Sekundärstrahlungen wie freigesetzte Elektronen und Röntgenstrahlung auf. Insgesamt ergeben sich – für den Organismus meist schädliche – Wirkungen durch das Aufbrechen chemischer Bindungen. Die Folgen können am bestrahlten Organismus selbst (somatische Schäden) oder, durch Schädigung des Erbguts, an seinen Nachkommen als genetische Schäden auftreten.
- Bei geladenen Teilchenstrahlungen nimmt die Intensität der Gammastrahlung mit der Eindringtiefe ab. Die Eindringtiefe hängt von der Wellenlänge der Gammastrahlung und von der Ordnungszahl des abschirmenden Materials ab: Blei ist deshalb das gängigste zum Strahlenschutz gegen Gammastrahlung verwendete Material.
Anwendungen der Radioaktivität
Es gibt einige Anwendung in der Medizin, siehe 19px Nuklearmedizin .
Nutzung der Radioaktivität zu Altersbestimmung ... wie etwa die C14-Methoden/Radio-Kohlenstoff-Datierung
Woher wissen wir so viel über das Universum?
Analysemethoden in der Chemie
| Die Titration ist ein Verfahren der quantitativen Analyse in der Chemie. Ein bekannter Stoff, dessen Menge/Konzentration aber unbekannt ist, wird durch Hereintröpfeln mit einer Maßlösung (bekannte Konzentration) in einer chemischen Reaktion umgesetzt. Das Volumen der verbrauchten Maßlösung wird gemessen und die Menge/Konzentration berechnet. |
| Die Spektroskopie eine analytische Methode, die meist zur qualitativen Analyse eingesetzt wird. Dabei wird zum Beispiel das emitierte Lichtspektrum einer Probe mit einem Prisma aufgespalten und die sichtbaren Spektrallinien mit bekannten Spektren verglichen. |
- Mehr dazu auf der Unterseite Spektren.
Schalen-Modell - Wiederholung
Hier wird im Periodensystem farbig dargestellt, in welche Schale ein neues Elektron hinzukommt, im Vergleich zum Element mit einer um eins kleineren Ordnungszahl.
Verbindungen von Atomen - Ionen und MolekülVerbindungen
- Wiederholung - Übungen zu Ionen
- Atombindungen ... warum das Schalenmodell nicht reicht! - Video
- Erklärungen zur Herleitung des Kugelwolkenmodells - Video 1 und Video 2.
Die Geometrie von Verbindungen
Wiederholung aus der Mittelstufe zur verschiedenen Themen
- Stöchiometrie: Berechnung der Masse von Teilchen - Berechnung der Molmasse - Benutzung des Übersichtsblattes zu den Maßangaben
- Symbolschreibweise, Reaktionsgleichungen: Aufstellen und Ausgleichen von Reaktionsgleichungen - Einfache Reaktionsgleichungen ausgleichen - Sehr schwere Reaktionsgleichungen ausgleichen
- Lewisschreibweise: Lewis-Schreibweise bei Molekülen - Atombindung und Lewis-Schreibweise
30px Aufgabe
Dieses Dokument enthält Übungen zur Stöchiometrie mit allen Lösungen. Bearbeitet sie selbstständig und kontrolliert sie selber. Treten Fragen bei konkreten Aufgaben auf, so können diese Fragen gestellt werden, indem der eigene Lösungsansatz vorgestellt wird. Hinweis: Natürlich kann es vorkommen, das die von mir erstellten Lösungen Fehler enthalten. Bitte teilt mir diese dann mit! |
Modul ET - Entwicklung von Treibstoffen
Energie bei chemischen Reaktionen
Daten: Enthalpie-Werte wie zum Beispiel ...
Hier ein paar Videos (zunächst erst einmal zwei Stück) zu Energetische Betrachtung von chemischen Reaktionen:
Erdölverarbeitung
Oktanzahl
30px Aufgabe
Nutze das in der Schule installierte Programm Avogadro, um Alkane zu zeichnen, wie sie in der Aufgabe angegeben sind. Wie das Programm Avogadro funktioniert, wird in den folgenden Videos erklärt. Download-Seite für zu Hause. Zur Aufgabenstellung im Arbeitsauftrag 7 auf Seite 34:
|
| Vorstellung von Avogadro (1) | Vorstellung von Avogadro (2) |
| Im ersten Teil der Reihe wird gezeigt, wie man in Avogadro Moleküle zeichnet, diese von verschiedenen Seite betrachten kann und bearbeitet. | Es wird gezeigt, wie man Benzol zeichnen kann. Zwischendurch wird bei Cyclohexan gezeigt, dass man verschiedene Konformere zeichnen kann. Und dann werden verschiedene Darstellungsarten gezeigt, wie auch eine Art Kalottenmodell. |
| Funktionsweise des Otto-Viertakt-Motors | Funktionsweise des Diesel-Viertakt-Motors | |
Unterschied zwischen Diesel und Benzin
Ein Überblick zum Thema Oktanzahl.
Für Interessierte: Terra X - Das Diesel Rätsel
Modul Q: Aus tiefen Quellen
Modul WM - Entwicklung von Arzneimitteln
Doppelspalt-Experiment:
Elektronen als stehende Wellen in Elektronenschalen
- De Broglie gilt als einer der bedeutendsten Physiker des 20. Jahrhunderts, der für seine Entdeckung der Wellennatur des Elektrons (Welle-Teilchen-Dualismus) in seiner Dissertation 1929 den Nobelpreis für Physik erhielt.
Datei:Vibration corde trois modes petit.gif
Orbital-Modell
Doppelbindung beim Ethen - Seite mit Erklärungen usw.
Modul M - Maßgeschneiderte Materialein
Polyester
Wichtige Poylester sind ...
- PET = 19px Polyethylenterephthalat
- Die Monomere, aus denen PET hergestellt wird, sind Terephthalsäure (1,4-Benzoldicarbonsäure) und Ethylenglycol (1,2-Dihydroxyethan, Ethan-1,2-diol).
- PET ist polar, wodurch starke zwischenmolekulare Kräfte vorhanden sind. Das Molekül ist zudem linear ohne Vernetzungen aufgebaut. Beides sind Voraussetzungen für teilkristalline Bereiche und Fasern. Durch diese Bereiche ergibt sich auch eine hohe Bruchfestigkeit und Formbeständigkeit bei einer Temperatur über 80 °C.Datei:Pet plastic crystallisation.jpgFlaschenstück, das erhitzt und wieder abgekühlt wurde. Dabei fand eine Kristallisation statt.
- In der Lebensmittelindustrie wird PET bevorzugt eingesetzt. Es kann amorph verarbeitet werden und ist in dieser Form absolut farblos und von hoher Lichtdurchlässigkeit. Es wird für Lebensmittelverpackungen und Flaschen eingesetzt wie z. B. die PET-Flasche.
- PC = 19px Polycarbonat(e)
- Polycarbonate sind in der Regel amorph und weisen einen Kristallitanteil von weniger als 5 % auf. Sie zeichnen sich durch hohe Festigkeit, Schlagzähigkeit, Steifigkeit und Härte aus. Außerdem sind Polycarbonate gute Isolatoren gegen elektrischen Strom.
- Polycarbonat ist verhältnismäßig teuer. Es wird daher fast nur dort eingesetzt, wo andere Kunststoffe zu weich, zu zerbrechlich, zu kratzempfindlich, zu wenig formstabil oder nicht transparent genug sind. Darüber hinaus wird Polycarbonat als transparenter Kunststoff wie auch Polymethylmethacrylat (PMMA) oder Styrol-Acrylnitril (SAN) häufig als Glas-Alternative eingesetzt. Im Vergleich zum spröden Glas ist Polycarbonat leichter und deutlich schlagfester.
Warum sind Kunststoffe transparent ?
Bei Kunststoffen mit kristallinen Bereichen wird das Licht an der Grenzfläche der einzelnen Kristallikristallinen Bereiche gebrochen. Das Licht wird gebrochen und dabei abgelenkt. Außerdem haben die zwischen den Kristallen liegenden amorphen Gebiete haben eine andere optische Dichte. Durch die vielfache Brechung des einfallenden Lichts wird das Material dann opak oder undurchsichtig.
Durchgehend amorphe Polymere hingegen sind optisch gleichförmig. Das Licht wird nur einmal bei Eintritt und einmal bei Austritt aus dem Material gebrochen.
Verstreckt man durchsichtige Kunststoffe so bilden sich meist kristalline Bereiche, die ja erwünscht sind, um die Stabilität zu erhöhen. Diesen Übergang vom amorphen zu teilkristallinen Verhalten kann man z.B. beobachten, denn beim Strecken erscheinen im Material weiße Schlieren.
Polyurethane
Polyurethane (Kurzzeichen PUR; im Sprachgebrauch auch PU) sind Kunststoffe, die aus der Polyadditionsreaktion von Dialkoholen (Diolen) beziehungsweise Polyolen mit Polyisocyanaten entstehen. Charakteristisch für Polyurethane ist die Urethan-Gruppe (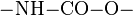 ).
).
Datei:Addition zu Polyurethan.svg
1937 synthetisierte eine Forschergruppe um Otto Bayer in den Laboratorien der I.G. Farben in Leverkusen zum ersten Mal Polyurethane aus 1,4-Butandiol und Octan-1,8-diisocyanat und später aus Hexamethylendiisocyanat (Hexan-1,6-diisocyanat).
Hexamethylendiisocyanat. Datei:Hexamethylene-diisocyanate-2D-skeletal.png
Datei:Polyaddition Polyurethane V.2.png
Toxizität Isocyanate können Allergien auslösen und stehen im Verdacht, Krebs zu verursachen. Wenn Polyurethane ausreagiert sind und keine Monomere mehr enthalten, besitzen sie in der Regel keine gesundheitsschädlichen Eigenschaften.
Alte Themen
Aromaten
Waschmittel
- Tenside und ihre Wirkung auf die Oberflächenspannung ... viele Infomationen auf dieser Seite.